Nested-PCR Detection of Taro Leaf Blight Pathogen Phytophthora colocasiae
-
摘要:目的 建立芋疫霉菌快速、准确的PCR检测技术,为芋疫病流行规律监测和综合防控提供科学依据。方法 根据芋疫霉菌与其他疫霉菌种类Ypt1基因序列差异,设计了1对芋疫霉菌PCR检测特异引物PCOF/PCOR,并对该引物的特异性、灵敏性和应用性进行了验证。结果 在优化的反应体系与扩增条件下,PCOF/PCOR引物能特异性地从芋疫霉菌基因组DNA中扩增出1条172 bp的条带,而其他供试病原菌均无扩增条带。在25 μL PCR反应体系中,PCOF/PCOR引物对芋疫霉菌基因组DNA的检测灵敏度为100 pg,而以疫霉菌Ypt1基因通用引物ph1F/Yph2R为第一轮引物,PCOF/PCOR为第二轮引物,进行巢式PCR扩增,能检测到10 fg芋疫霉菌基因组DNA,检测灵敏度提高了10 000倍。采用巢式PCR,可从芋疫病发病的叶片和未显症叶片组织中检测到芋疫霉菌,检出率分别为100%和57.5%。结论 所建立的巢式PCR可应用于芋疫霉菌的快速、特异和高灵敏度检测。Abstract:Objective To develop a PCR assay for rapid and accurate detection, epidemiology information, and integrated disease management on Phytophthora colocasiae, the pathogen of taro phytophthora blight.Method A pair of species-specific primers, PCOF/PCOR, for P. colocasiae was designed based on the differences in Ras-related protein (Ypt1) gene sequence between P. colocasiae and other species in the same genus. The specificity, sensitivity and applicability of the primers were evaluated.Result With the optimized reaction conditions and amplification, PCOF/PCOR amplified only a single band of 172 bp with genomic DNA extracted from all P.colocasiae strains, while the other tested pathogens had no corresponding band. The sensitivity of conventional PCR method using PCOF/PCOR as primers was 100 pg of genomic DNA in a 25 μL reaction solution. Whereas, the newly developed nested-PCR performed using Ypt1 gene universal primers ph1F/Yph2R for the first-round and PCOF/PCOR for the second-round increased 10 000-fold on the sensitivity to 10 fg. The nested-PCR methodology could positively detected P. colocasiae 100% in diseased leaves or 57.5% in symptom-free infected tissues.Conclusion The newly established nested-PCR assay could be used for rapid, specific and sensitive detection of P. colocasiae.
-
Keywords:
- Phytophthora colocasiae /
- specific primer /
- nested-PCR /
- molecular detection
-
0. 引言
【研究意义】含两个以上草坪草种或品种的混播草坪,遗传背景广泛,适应力较强[1],成坪速度快,并能保持草坪质量的稳定性,延长草坪寿命,但不易获得颜色纯一的草坪[2]。多种、多品种的混植和混合播种,在提高建坪速度和延长草坪的使用年限[3]、培育健康草坪上具有重大意义[4-6]。东北地区夏季炎热,降水集中,影响草坪的正常发育,降低了草坪的观赏性。夏季采用播种方式成坪是观赏草坪的难题,采用草皮建植草坪是在夏季成坪最好的办法,但是建植草皮与直接播种相比成本较高。如何解决东北地区草坪越夏难题,延长其使用年限,具有重要研究及应用价值[7]。冷季型草坪草在不同混播比例、不同光照条件下的混播草坪质量的研究,对改变东北地区夏季草坪现状有一定的实际意义。【前人研究进展】草坪建植成坪的质量不仅与草坪草品种及其配比相关,还与生长环境因素相关。草地早熟禾是我国北方最主要的城市绿地草坪建群种之一,但因其出苗慢,易受杂草侵害,用直播的方法建坪不易成坪,尤其遮荫条件单播草地早熟禾建坪更难[8]。紫羊茅是禾本科羊茅属多年生草本植物,在我国北方地区被广泛应用,拥有繁殖力强、再生性好、寿命长、耐旱、抗寒和返青早等特点[9]。多年生黑麦草成活年限依生境变化而不同,且其对温度适应能力较差,对坪用质量有一定的负面影响,因此在混播时对其含量的控制是成坪的重要因素[10]。【本研究切入点】吉林地区存在草坪品种和建植模式单一、总体建坪质量低下等问题,适于本地区的混播草坪组合研究尚未见报道。且在自然情况下,由于建筑物、植物或其他遮挡物,或不同强弱紫外线,草坪会受到不同程度的光照影响。而不同光照处理对草坪影响的研究多局限于草坪草单播的生长量与光合指标的测定[9, 11],对混播草坪质量影响的报道较少。【拟解决的关键问题】本试验对两种或两种以上草坪草,按不同比例在夏季直接混播种植,比较不同冷季型草坪草组合的混播成坪表现,以期筛选出夏季吉林地区在全光照及遮阴条件下表现较好的草坪组合形式及混播比例。
1. 材料与方法
1.1 材料
供试材料为草地早熟禾Poapratensis L.品种:优美(Euromyth)、肯塔基(K.B.G), 紫羊茅(Festuca rubra)品种:梦神(Rubra),多年生黑麦草Loliumperenne L.品种:轰炸机(Bomber), 以及狗牙根Cynodondactylon Pers.品种:普通狗牙根(Common)。试验于2017年6~8月在吉林农业大学园艺学院园林专业实验室和吉林农业大学设施农业基地园林实训基地进行。试验土壤pH7.3,有机质含量1.32%,水解氮35.9 mg·kg-1,速效钾45.3 mg·kg-1,速效磷12.9 mg·kg-1。
1.2 方法
1.2.1 发芽试验
采用培养皿发芽法,分别取供试的草坪草品种100粒,整齐放置在培养皿当中,下层铺滤纸,加入适量无菌水放入培养箱(25±2℃、避光)中进行培养,每个处理3次重复, 计算5个草坪草品种的发芽率和发芽势,为后期播种试验的播种量估算提供依据。
1.2.2 混播处理
采用盆栽法,将土壤(园土:沙土=3:1)置于盆钵(顶部直径20 cm/底部直径17 cm/高度19 cm)2/3高度处,压实土壤,均匀撒种,(理论播种量均为159.2 g·m-2,每盆理论播种量为5 g, 露地播种损耗比例为15%),撒种后再次覆盖薄土层,浇水至全透,覆盖遮阴网,待出壮苗后移除,放置到全光照及遮阴条件下进行试验,除正常降水之外,保持土壤湿度在85%左右,生长超过4 cm后每3~4 d修剪至4 cm基点。试验设3次重复。
根据孙吉雄[12]的研究结果,以多年生黑麦草:草地早熟禾=1:2、多年生黑麦草:紫羊茅=1:2、多年生黑麦草:草地早熟禾:狗牙根=2:5:3为对照,设置多年生黑麦草轰炸机与草地早熟禾优美混播(试验组A)、多年生黑麦草轰炸机与紫羊茅梦神混播(试验组B),以及多年生黑麦草轰炸机、草地早熟禾肯塔基和普通狗牙根3种混播处理(试验组C)。狗牙根为暖季型草坪草,且3种草种混播狗牙根作为保护种,因此狗牙根在试验中的比例不改变,具体混播比例和实际播种量见表 1。每一盆中的草种理论总播种量均为5 g。理论上每种草的露地播种损耗比例为15%,即实际草种播种量的计算公式为:实际草种播种量=理论总播种量×(1-露地播种损耗比例)/发芽率。
表 1 播种比例及播种量Table 1. Mixing ratios and quantities of seeds处理
Treatment轰炸机
Bomber优美
Euromyth梦神
Rubra肯塔基
K.B.G普通狗牙根
CommonA1(CK) 1(86.9) 2(128.6) A2 1(58.3) 4(154.7) A3 3(78.0) 7(135.3) A4 2(104.1) 3(115.9) B1(CK) 1(86.0) 2(125.8) B2 1(52.2) 4(152.5) B3 3(78.0) 7(133.4) B4 2(104.1) 3(114.3) C1(CK) 2(52.2) 5(135.3) 3(202.6) C2 3(78.0) 4(108.3) 3(202.6) C3 4(104.1) 3(81.2) 3(202.6) C4 1(26.1) 6(102.4) 3(202.6) 注:表中括号内数字为播种量,单位为g·m-2。
Note:The data in the parentheses was seeding ralte, g·m-2.为了确定不同光照条件对混播草坪成坪质量的影响,不同草种混播组合均设置全光照和遮阴(50%光照)条件处理。试验设置12个混播处理,两种光照处理,共24个处理,每个处理3次重复。
1.3 指标测定
成坪速度:播种至盖度达90%的天数。盖度采用方格网针刺法,样方采用10 cm×10 cm,平均分为100个格,统计植物种与针接触的次数。播种15 d后,每5 d测定1次,当盖度大于80%后,每2 d测定1次。
密度:用实测法测定。随机选取点面积2 cm×2 cm,在每点放置样方框,计数株数,用株·cm-2表示,每处理3次重复。密度测定时间在播种后60 d。
生长速度:每次修剪前后测量植株绝对高度,根据间隔天数,计算生长速度,用cm·d-1表示。测定时间为所有处理生长超过6 cm后每3 d测定1次。
质地:每处理按照“对角线法”选取5点,每点随机选3个叶片,用直尺测定叶片最宽处的宽度,用cm表示。质地测定时间在播种后60 d。
颜色:用目测法,肉眼观察测定,采用5分制,1为枯黄,2为黄绿,3为浅绿,4为翠绿,5为深绿,每组按照“对角线法”选取5点,每组随机测定3个叶片,颜色测定时间在播种后30、45、60 d。
生物量:每盆按“对角线法”选取5点,每点分别取2 cm×2 cm样方样品,洗净后带回实验室,在70℃下烘至恒重,用电子天平称重,g·m-2。
1.4 草坪质量评价
选取成坪速度、密度、生长速度、质地、颜色、生物量6个指标,参考孙吉雄[12]、刘建秀[13]、朱明等[14]有关草坪质量评价方法并根据实际情况,按观赏草坪确定各指标的权重(表 2),对草坪质量进行评价。
表 2 草坪质量评价指标权重Table 2. Turf quality indices and weights for lawn evaluation评价指标
Evaluation intex成坪速度
Turf speed密度
Density生长速度
Growth rate质地
Turf texture颜色
Color生物量
Biomass权重Weight 0.05 0.25 0.25 0.25 0.1 0.1 1.5 数据处理
数据处理采用SPSS 20.0和Excel 2013,混播组合不同混播比例对草坪的各项指标影响采用Duncan新复极差法进行显著性分析,并对各项指标数据进行标准化,根据权重计算结果。
2. 结果与分析
2.1 草种发芽率
采用培养箱模拟夏季温度进行种子萌发试验,计算草坪草的发芽率,为播种量估算提供依据。结果表明,优美发芽率70%,轰炸机发芽率52%,梦神发芽率71%,狗牙根发芽率20%,肯塔基发芽率50%。
2.2 不同光照处理和不同混播比例对草坪坪用性状的影响
2.2.1 不同光照处理和不同混播比例对混播草坪成坪速度的影响
表 3显示,A组、B组、C组在遮阴条件下全部成坪,在全光照条件下仅C组成坪,其他两组处理全部不成坪。C1、C2、C3、C4处理在遮阴处理下的成坪速度分别比全光照下的成坪速度快4%、27.6%、25.8%、11.4%。在遮阴条件下,A组内A1组最快成坪,23 d达到成坪标准;B组内B1组最快成坪,27 d达到成坪标准;C组内C2处理成坪最快,21 d达到成坪标准。在全光照条件下A、B、C组处理仅有C组成坪,其他两组处理全部不成坪,最快成坪的组合为C1组合,24 d达到成坪标准。说明全光照条件下,轰炸机:肯塔基:普通狗牙根=2:5:3(C1处理)的草坪成坪速度表现最好,遮阴条件下轰炸机:肯塔基:普通狗牙根=3:4:3(C2处理)草坪成坪速度表现最好。
表 3 不同冷季型草坪草混播比例组合下草坪坪用性状Table 3. Performance of lawns with various combinations of cold-season turfgrass under differed light conditions组合处理
Treatment成坪速度
Turf speed
/d密度
Density
/(株·cm-2生长速度
Growth rate
/(cm·d-1)质地
Turf texture
/cm颜色
Color生物量
Biomass
/(g·m-2)全光照处理Full light conditions A1 - 0.50±0.07ij 0.26±0.06hij 0.19±0.05cdefgh 2.64±0.47ab 320±70.00jk A2 - 0.25±0.06lm 0.20±0.06j 0.15±0.04fgh 2.27±0.17b 160±35.121 A3 - 0.42±0.04ijk 0.32±0.09hij 0.24±0.05abc 2.58±0.24ab 350±73.71ijk A4 - 0.58±0.08i 0.26±0.06hij 0.26±0.05ab 2.78±0.30ab 270±70.24kl B1 - 0.33±0.05kl 0.22±0.04ij 0.24±0.04abc 2.64±0.43ab 640±75.50de B2 - 0.16±0.03m 0.21±0.07ij 0.15±0.04fgh 2.94±0.61ab 350±61.10ijk B3 - 0.50±0.05ij 0.27±0.04hij 0.20±0.06bcdefgh 3.09±0.70ab 450±149.33ghij B4 - 0.41±0.10jk 0.39±0.03gh 0.29±0.05a 2.80±0.47ab 490±45.09fghi C1 24 0.83±0.08gh 0.35±0.07ghij 0.22±0.05abcdef 2.58±0.63ab 830±47.26bc C2 29 0.92±0.06fg 0.31±0.04hij 0.20±0.04bcdefgh 2.47±0.76ab 700±65.57cd C3 31 0.75±0.11h 0.36±0.07ghi 0.26±0.05ab 2.47±0.68ab 620±106.93def C4 35 0.57±0.05i 0.31±0.05hij 0.23±0.03abcd 2.44±0.60ab 340±45.09jk 遮阴处理Shade conditions A1 23 1.83±0.07b 0.86±0.08bc 0.16±0.01defgh 2.76±0.50ab 1060±121.24a A2 29 1.58±0.10c 0.77±0.11cd 0.21±0.03bcdefg 2.62±0.57ab 750±65.06bcd A3 27 1.67±0.06c 0.77±0.20cd 0.17±0.01cdefgh 3.16±0.51ab 550±96.09efg A4 35 2.00±0.12a 0.83±0.07bc 0.14±0.02gh 3.22±0.50ab 630±77.67de B1 27 1.63±0.13c 0.97±0.09b 0.14±0.03h 2.93±0.24ab 630±50.33de B2 33 1.13±0.14e 0.95±0.08b 0.17±0.02defgh 3.42±0.71ab 400±73.701hijk B3 35 0.93±0.09fg 0.85±0.05bc 0.16±0.02efgh 3.58±0.68a 420±65.57ghij B4 39 1.40±0.18d 1.16±0.07a 0.23±0.04abcde 3.20±0.53ab 520±95.39efgh C1 25 0.89±0.05fgh 0.47±0.07fg 0.18±0.02cdefgh 2.91±0.84ab 840±70.95b C2 21 1.25±0.08de 0.59±0.13ef 0.19±0.03bcdefgh 2.95±0.69ab 880±65.57b C3 23 1.00±0.15f 0.66±0.06de 0.19±0.03bcdefgh 2.89±0.60ab 640±62.45de C4 31 0.83±0.12gh 0.38±0.02gh 0.22±0.04abcde 3.24±1.21ab 450±65.06ghij 注:同列数据后不同小写字母表示差异显著(P<0.05),“-”观测期内未成坪。
Note: Different lowercase letters in the same column indicate significant difference (P < 0.05), and “-” is not flat during the observation period.2.2.2 不同光照处理和不同混播比例对混播草坪密度的影响
表 3显示,A组、B组、C组草坪密度在遮阴条件下均高于全光照条件。A组、B组在遮阴条件与全光照条件下相同混播比例的草坪密度存在显著差异。C组中C1处理在遮阴条件与全光照条件下的草坪密度差异不显著,其他处理差异均显著。A组中,A4处理在遮阴条件下的草坪密度最大,达2.00,显著高于其他处理;在全光照条件下,A4处理草坪密度也最大,为0.58,与A1、A3差异不显著,显著高于A2处理。B组在遮阴条件下,B1处理草坪密度最大,达1.63,显著高于其他处理;在全光照条件下,最大值为B3处理,为0.50,与B4差异不显著,显著高于B1、B2处理。C组在遮阴条件下,C2处理草坪密度最大,达到1.25,显著高于其他处理;在全光照条件下,最大值也为C2处理,为0.92,与C1处理差异不显著,与C3、C4处理差异显著。说明全光照条件下,轰炸机:肯塔基:普通狗牙根=3:4:3(C2处理)的草坪密度最大,遮阴条件下轰炸机:优美=2:3(A4处理)草坪密度较好。
2.2.3 不同光照处理和不同混播比例对混播草坪生长速度的影响
表 3显示,各处理组在遮阴条件下的生长速度均高于全光照条件。A组、B组在遮阴条件与全光照条件下相同混播比例的草坪生长速度差异均显著。C组中C1、C4处理在遮阴条件下与全光照条件下草坪生长速度差异不显著,其他处理差异均显著。A组在遮阴条件下,最大值为A1处理,达0.86 cm·d-1;在全光照条件下,最大值为A3处理,为0.32 cm·d-1,但各处理间均无显著差异。B组在遮阴条件下,最大值为B4处理,达1.16 cm·d-1,显著高于其他处理;在全光照条件下,B4处理的生长速度也最快,为0.39 cm·d-1,与B3差异不显著,显著高于B1、B2处理。C组在遮阴条件下,C3处理的生长速度最快,为0.66 cm·d-1,与C2处理差异不显著,与C1、C4处理差异显著;在全光照条件下,C3处理的生长速度也最快,达0.36 cm·d-1,但与其他处理无显著差异。不同光照条件下,轰炸机:梦神=2:3(B4处理)的草坪生长速度表现均最好。
2.2.4 不同光照处理和不同混播比例对混播草坪草质地的影响
表 3显示,不同处理组在遮阴条件下的草坪质地整体优于全光照条件。A组中A4处理遮阴条件下与全光照条件下的草坪质地差异显著,其他处理差异均不显著。B组中B1处理遮阴条件下与全光照条件下的草坪差异显著,其他处理差异均不显著。C组在遮阴条件与全光照条件下相同混播比例的质地差异均显著。A组在遮阴条件下,最优为A4处理,达到0.14 cm,差异不显著;在全光照条件下,最优为A2处理,为0.15 cm,与A1差异不显著,但显著优于A3、A4处理。B组在遮阴条件下,最优为B1处理,达到0.14 cm,B1处理与B4处理显著差异;在全光照条件下,最优值为B2处理,为0.15 cm,与B1、B4差异显著。C组在遮阴条件下,最优为C1处理,达0.18 cm,差异不显著;在全光照条件下,最优为C2处理,为0.20 cm,与其他处理均无显著差异。说明全光照条件下,轰炸机:优美=1:4(A2处理)的草坪质地最好,遮阴条件下轰炸机:优美=2:3(A4处理)、轰炸机:梦神=1:2(B1处理)草坪质地均最好。
2.2.5 不同光照处理和不同混播比例对混播草坪颜色的影响
表 3显示,各处理组混播草坪颜色在遮阴条件下整体优于全光照条件,遮阴条件与全光照条件下相同混播比例的草坪生长速度差异均不显著。A组在遮阴条件下,最优为A4处理,分值达3.22;在全光照条件下,A4处理也最优,分值为2.78。B组在遮阴条件下,最优值为B3处理,分值为3.58,处理均无显著差异;在全光照条件下,最优也为B3处理,分值为3.09,处理均无显著差异。C组在遮阴条件下,最优为C4处理,分值达到3.24,无显著差异;在全光照条件下,最优值也为C4处理,分值为2.58,与其他处理均无显著差异。不同光照条件下,轰炸机:梦神=3:7(B3处理)的草坪颜色表现均最好。
2.2.6 不同光照处理和不同混播比例对混播草坪生物量的影响
表 3显示,各处理组在遮阴条件下的生物量均高于全光照条件,A组在遮阴条件与全光照条件下相同混播比例的草坪生物量存在显著差异,B组在遮阴条件与全光照条件下相同混播比例的草坪生物量差异均不显著,C组中C2处理遮阴条件下与全光照条件下的草坪差异显著,其他处理差异均不显著。A组在遮阴条件下,A1处理草坪生物量最高,达到1 060 g·m-2,显著高于其他处理;在全光照条件下,A3处理草坪生物量也最高,为350 g·m-2,显著高于A2处理。B组在遮阴条件下,B1处理草坪生物量最高,达到630 g·m-2,显著高于B2、B3处理;在全光照条件下,B1处理草坪生物量也最高,为640 g·m-2,显著高于其他处理。C组在遮阴条件下,C2处理草坪生物量最高,达到880 g·m-2,显著高于C3、C4处理;在全光照条件下,C1处理草坪生物量最高,为830 g·m-2,显著高于C3、C4处理。全光照条件下,轰炸机:肯塔基:普通狗牙根=2:5:3(C1处理)的草坪生物量最高,遮阴条件下轰炸机:优美=1:2(A1处理)草坪生物量最高。
2.3 不同混播比例与不同光照处理草坪的综合质量评价
对表 3的实测值进行标准化处理,并根据表 2草坪质量评价各指标的权重,对不同混播比例的冷季型草坪草组合的草坪质量进行综合评价,结果见表 4。由表 4可知,全光照条件下的A1处理综合质量最优,A4处理综合质量最差。B组全光照条件下的B3处理综合质量最优,B4处理综合质量最差。C组全光照条件下的C2处理综合质量最优,C4处理综合质量最差。A组在遮阴条件下的A1处理综合质量最优,A2处理综合质量最差。B组在遮阴条件下的B1处理综合质量最优,B2处理综合质量最差。C组在遮阴条件下的C2处理综合质量最优,C4处理综合质量最差。
表 4 不同光照处理和不同混播比例组合标准化值及草坪质量综合评价Table 4. Normalized scores on evaluation indices and quality assessment on lawns built with various combinations of cold-season turfgrass under differed light conditions组合处理
Treatment成坪速度
Turf speed密度
Density生长速度
Growth speed质地
Turf texture颜色
Color生物量
Biomass综合评价得分
Comprehensive evaluation score排序
Sort全光照处理Full light condition A1 0 0.187 0.103 0.620 0.457 0.190 0.292 1 A2 0 0.063 0.047 0.817 0.350 0.037 0.271 2 A3 0 0.150 0.157 0.350 0.437 0.217 0.230 3 A4 0 0.227 0.103 0.273 0.497 0.140 0.215 4 B1 0 0.103 0.063 0.353 0.460 0.497 0.226 3 B2 0 0.013 0.057 0.793 0.540 0.223 0.292 2 B3 0 0.190 0.110 0.550 0.587 0.317 0.303 1 B4 0 0.143 0.220 0.157 0.503 0.347 0.215 4 C1 0.58 0.353 0.183 0.473 0.437 0.680 0.393 2 C2 0.52 0.397 0.147 0.550 0.407 0.553 0.396 1 C3 0.48 0.313 0.193 0.270 0.403 0.480 0.307 3 C4 0.42 0.223 0.147 0.413 0.397 0.207 0.277 4 遮阴处理Shade condition A1 0.62 0.853 0.653 0.740 0.490 0.893 0.731 1 A2 0.52 0.727 0.587 0.513 0.450 0.603 0.588 4 A3 0.55 0.767 0.570 0.680 0.603 0.413 0.633 3 A4 0.42 0.937 0.623 0.830 0.623 0.490 0.730 2 B1 0.55 0.770 0.753 0.863 0.540 0.490 0.727 1 B2 0.45 0.523 0.737 0.727 0.680 0.263 0.614 4 B3 0.42 0.393 0.643 0.773 0.723 0.287 0.574 2 B4 0.35 0.603 0.927 0.423 0.617 0.383 0.606 3 C1 0.58 0.380 0.293 0.633 0.533 0.690 0.478 3 C2 0.65 0.560 0.407 0.593 0.547 0.723 0.550 1 C3 0.62 0.433 0.467 0.610 0.527 0.497 0.511 2 C4 0.48 0.353 0.210 0.433 0.630 0.317 0.368 4 3. 讨论
3.1 不同混播比例与不同光照对草坪综合质量的影响
草坪质量是多因素的综合反应,主要取决于草坪的密度、颜色、质地、生物量等坪用性状和成坪速度。但单纯的用某一指标来评价草坪质量不切实际,应综合考虑反映草坪整体质量的所有指标以及各自的重要性。全光照条件下,A1处理为A组中最优处理,罗富成等[15]提出不同配比的草地早熟禾混播草地,早熟禾的百分含量60%为最佳配比,孙吉雄[16]提出不同配比的草地早熟禾建立混播草坪,草地早熟禾的百分含量最佳配比为70%,本研究中草地早熟禾含量为66.7%为最佳配比,与上述研究结果基本类似。B3处理为B组在全光照条件下的最优处理,与白文祖等[17]提出的不同配比的紫羊茅混播草地,紫羊茅的百分含量70%为最佳配比的结果一致。C2处理为C组在全光照条件下最优处理,这与张晔等[18]提出的草地早熟禾:狗牙根:多年生黑麦草=5:3:2为云南地区运动场草坪最适混播比例不一致,应该是试验中保护种与建坪种选择对象不同、建坪目标与建坪时间的不同导致的差异。C2处理在全光照条件与遮阴条件下均为最优处理,这与孙吉雄[12]提出的C1处理混播比例为最优混播比例的结果不一致,这应是试验草种品种与试验地气候不同导致的建群种、伴生种、保护种在混播成坪中产生差别所导致的结果。冷季型草坪草的最适温度是10~24℃[19],长春夏季炎热,全天温度在最适以上,不同混播比例组合在不同光照处理出现了不同的结果:两种草坪草混播处理遮阴条件下评分整体高于全光照条件,3种草坪草混播处理在遮阴条件与全光照条件下都出现了评分优秀的处理,含有保护种的3个草坪草混播组合在全光照条件下整体状况优于两种草坪草混播处理,这与李文烁[20]提出有保护种的情况下草坪品质优于两种草坪草混播一致。在遮阴条件下草坪生物量大部分高于露地条件下,有试验证明,给予适当的遮阴可以增加草坪草的生物量[21],但也有前人研究发现遮荫显著地提高了草坪草的叶绿素a、b及整个叶绿素含量,降低了地上部生物量[22],这应该是因为两试验进行时环境温度不同导致的,本试验进行时温度已经超过冷季型草坪草最适生长温度。
3.2 不同混播比例与不同光照对实际建植的影响
2017年夏季播种的情况下,由于试验地基础整地操作规范、养护管理每项操作规范,试验结果比较规范,所有处理基本准确。在试验过程中出现了明显不适合实际建坪的问题,在全光照条件只有C组试验组全部成坪,草坪密度也符合草坪成坪的要求,在遮阴条件下,基本所有组合都达到了成坪要求,满足成坪所需要的密度要求。孙吉雄[16]报道,在草坪的建植过程中,草坪的应用性主要包括两方面的因素:一是成坪速度,二是成坪后草坪的质量;在草坪质量较好的前提下选择成坪速度快的草种配比是建植草坪基本原则。草坪生物量[23]是草坪景观质量和使用质量的基础,并且是草坪质量能否持久保持和适用的关键。多年生黑麦草轰炸机与草地早熟禾优美混播处理,多年生黑麦草轰炸机与紫羊茅梦神混播处理在全光照条件下没有成坪,在密度、生长速度、质地、生物量等方面也都差于遮阴条件,说明这两种混播处理在长春地区全光照条件下不适合种植,对于林下草地、疏林地等遮阴潮湿地适合采用两种冷季型草坪草混播。多年生黑麦草轰炸机与草地早熟禾优美混播处理在遮阴条件下,多年生黑麦草轰炸机:草地早熟禾优美=1:2最为合适,多年生黑麦草轰炸机与紫羊茅梦神混播处理在遮阴条件下,多年生黑麦草轰炸机:紫羊茅梦神=1:2最为合适。多年生黑麦草轰炸机、草地早熟禾肯塔基和普通狗牙根混播处理在全光照条件下,采用多年生黑麦草轰炸机:草地早熟禾肯塔基:普通狗牙根=3:4:3效果最好。在遮阴条件下,两种草坪草混播组合优于含有保护种狗牙根的3个草坪草品种混播组合;在全光照条件下,含有保护种狗牙根的3个草坪草品种混播组合在全光照条件下整体状况优于两种草坪草混播组合。
-
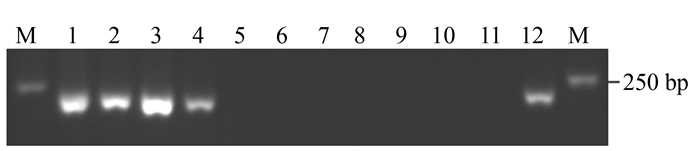
图 1 特异引物PCOF/PCOR PCR扩增产物电泳
注:泳道M为2 000 bp DNA Marker,泳道1~4、12为芋疫霉菌,泳道5~10分别为番茄晚疫病菌、辣椒疫霉菌、大豆疫霉菌、豇豆疫霉菌、樟疫霉菌和恶疫霉菌,泳道11为阴性对照。
Figure 1. Agarose electrophoresis of PCR amplified products with specific primers PCOF/PCOR
Note:M: 2 000 bp DNA Marker, 1-4, 12: Phytophthora colocasiae, 5-10: P. infestans, P. capsici, P. sojae, P. vignae, P. cinnamomi, P.cactorum, 11: Negative control.
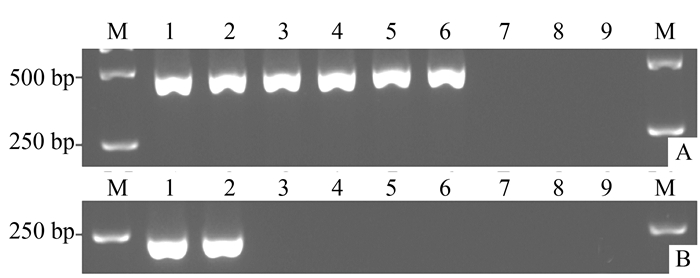
图 2 巢式PCR特异性检测电泳
注:①A为巢式PCR第一轮扩增检测结果,B为巢式PCR第二轮扩增检测结果。②泳道M为DL 2 000 bp DNA Marker,泳道1~2为芋疫霉菌,泳道3~8分别为辣椒疫霉菌、豇豆疫霉菌、番茄晚疫病菌、大豆疫霉菌、香蕉枯萎病菌和番茄灰霉病菌,泳道9为阴性(无菌水)对照。
Figure 2. Specificity of Nest-PCR for detection of Phytophthora colocasiae
Note:①A: First round of nested-PCR; B: Second round of nested-PCR.② M: 2 000 bp DNA Marker, 1-2: Phytophthora colocasiae, 3-8: P. capsici, P. vignae, P. infestans, P. sojae, Fusarium oxysoporum f. sp. cubense, Botrytis cinerea, 9: Negative control.
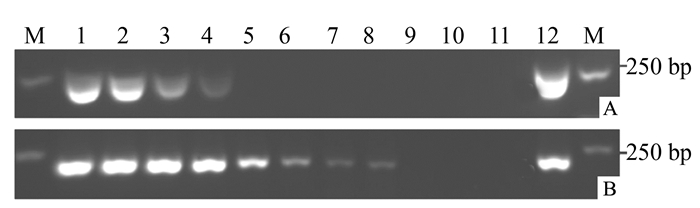
图 3 常规PCR和巢式PCR对芋疫霉菌基因组DNA系列浓度的检测灵敏度
注:①A为常规PCR灵敏性检测结果,B为巢式PCR灵敏性检测结果。②泳道M为DL 2 000 bp DNA Marker,泳道1为100 ng·μL-1,泳道2为10 ng·μL-1,泳道3为1 ng·μL-1,泳道4为100 pg·μL-1,泳道5为10 pg·μL-1,泳道6为1 pg·μL-1,泳道7为100 fg·μL-1,泳道8为10 fg·μL-1,泳道9为1 fg·μL-1,泳道10为100 ag·μL-1,泳道11为阴性对照,泳道12为阳性对照。
Figure 3. Sensitivity of conventional PCR and nested PCR
Note: ①A: Sensitivity of conventional PCR, B: Sensitivity of nested-PCR.②M: 2 000 bp DNA Marker, 1-10:100 ng·μL-1, 10 ng·μL-1, 1 ng·μL-1, 100 pg·μL-1, 10 pg·μL-1, 1 pg·μL-1, 100 fg·μL-1, 10 fg·μL-1, 1 fg·μL-1, 100 ag L-1, 11: Negative control, 12: Positive control.
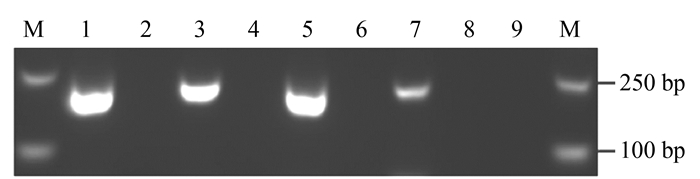
图 4 巢式PCR对植物叶片组织芋疫霉菌的PCR扩增检测
注:M为2 000 bp DNA Marker,泳道1为阳性对照,泳道2、4、6、8为健康叶片,泳道3为人工接种发病叶片,泳道5、7为田间自然发病叶片,泳道9为阴性对照。
Figure 4. Detection of Phytophthora colocasiaea from leave samples by Nest-PCR
Note:M: DL 2000bp DNA marker, 1: Positive control, 2, 4, 6, 8: Healthy leaves, 3: Artificial inoculation leaves, 5, 7: Naturally diseased leaves in the field, 9: Negative control.
表 1 供试菌株
Table 1 Tested strains
序号
No.种名Species 寄主host 来源
Locality数量Number of isolate 1 芋疫霉菌Phytophthora colocasiae 芋Colocasia esculenta 福建Fujian 15 2 芋疫霉菌P.colocasiae 芋C.esculenta 广西Guangxi 5 3 芋疫霉菌P.colocasiae 芋C.esculenta 广东Guangdong 5 4 芋疫霉菌P.colocasiae 芋C.esculenta 海南Hainan 6 5 恶疫霉菌P.cactorum 草莓Fragaria ananassa 福建Fujian 3 6 辣椒疫霉P.capsici 辣椒Capsicum annuum 福建Fujian 10 7 瓜疫霉菌P.melonis 黄瓜Cucumis sativus 福建Fujian 11 8 大豆疫霉菌P.sojae 大豆Glycine max 福建Fujian 3 9 烟草疫霉菌P.nicotianae 烟草Nicotiana tabacum 福建Fujian 2 10 樟疫霉菌 蓝莓Vaccinium corymbosum 福建Fujian 3 11 棕榈疫霉菌P.Palmivora 木瓜Chaenomeles sinensis 福建Fujian 6 12 苜蓿疫霉菌P.medicaginis 苜蓿Medicago Sativa 未知Unkown 1 13 致病疫霉菌P.infestans 番茄Solanum lycopersicum 福建Fujian 8 14 苎麻疫霉菌P.boehmeriae 棉花Gossypium spp 新疆Xinjiang 1 15 隐地疫霉菌P.cryptogea 非洲菊Gerbera jamesonii 未知Unkown 1 16 豇豆疫霉菌p.vignae 豇豆Vigna unguiculata 福建Fujian 6 17 荔枝霜疫霉菌Peronophythora litchi 荔枝Litchi chinensis 福建Fujian 1 18 瓜果腐霉Pythium aphanidermatum 黄瓜Cucumis sativus 福建Fujian 1 19 茄病镰孢菌Fusarium solani 番茄S.lycopersicum 福建Fujian 4 20 黄瓜枯萎病菌F.oxysporum.sp.cucumebrium 黄瓜Cucumis sativus 福建Fujian 6 21 香蕉枯萎病菌F.oxysporum f.sp.cubense 香蕉Musa nana 福建Fujian 6 22 甘薯蔓割病菌F.oxysporum f.sp.batatas 甘薯Dioscorea esculenta 福建Fujian 1 23 西瓜枯萎病菌F.oxysporium f.sp.niveum 西瓜Citrullus lanatus 福建Fujian 6 24 豇豆枯萎病菌F.oxysporum f.sp.tracheiphlium 豇豆V.unguiculata 福建Fujian 3 25 黄瓜炭疽病菌C.orbiculare 黄瓜C.sativus 福建Fujian 3 26 大豆炭疽病菌C.truncatum 大豆G.max 福建Fujian 3 27 胶孢炭疽菌C.gloeosporioides 柑橘Citrus reticulata 福建Fujian 1 28 香蕉炭疽病菌C.musae 香蕉Musa nana 福建Fujian 1 29 辣椒炭疽C.capsici 辣椒C.annuum 福建Fujian 1 30 立枯丝核菌Rhizoctonia solani 番茄S.lycopersicum 福建Fujian 1 31 番茄早疫病菌Alternaria solani 番茄S.lycopersicum 福建Fujian 1 32 烟草赤星病菌A.alternata 烟草N.tabacum 福建Fujian 1 33 番茄灰霉病菌Botrytis cinerea 番茄S.lycopersicum 福建Fujian 1 -
[1] SHRESTHA S, HU J, FRYXELLl R T, et al.SNP marker identify widely distributed clonal lineages of Phytophthora colocasiae in Vietnam, Hawaii and Hainan island, China[J]. Mycologia, 2014, 106(4): 676-685. DOI: 10.3852/13-165
[2] 王汉荣, 方丽, 茹水江, 等.槟榔芋疫病的识别与防治[J].中国蔬菜, 2009(21): 21-22. http://d.old.wanfangdata.com.cn/Periodical/zgsc200921009 WANG H R, SU L, RU S J, et al.Identification and control of taro phytophthora blight[J]. China Vegetables, 2009(21): 21-22.(in Chinese) http://d.old.wanfangdata.com.cn/Periodical/zgsc200921009
[3] 王向社, 李锐, 胡茂松, 等.海南岛芋疫霉菌生物学特性、致病力、对甲霜灵的敏感性研究[J].热带作物学报, 2001, 22(1): 83-90. DOI: 10.3969/j.issn.1000-2561.2001.01.014 WANG X S, LI R, HU M S, et al.Study on the biology, virulence of Phytophthora colocasiae Racib and its sensitivity to metalaxyl[J]. Chinese Journal of Tropical Crops, 2001, 22(1): 83-90.(in Chinese) DOI: 10.3969/j.issn.1000-2561.2001.01.014
[4] QUITUGUA R J, TRUJILLO E E.Survival of Phytophthora colocasiae in field soil at various temperatures and water matric potentials[J]. Plant Disease, 1998, 82(2): 203-207. DOI: 10.1094/PDIS.1998.82.2.203
[5] 刘独臣.四川芋疫病发生规律及防治技术[J].长江蔬菜, 2013, 18: 118-119. DOI: 10.3865/j.issn.1001-3547.2013.18.038 LIU D C.Epidemiology and control of taro phytophthora blight in Sichuan[J]. Journal of Changjiang Vegetables, 2013, 18: 118-119.(in Chinese) DOI: 10.3865/j.issn.1001-3547.2013.18.038
[6] VASGUEZ E A.Yield loss in taro due to Phytophthora leaf blight[J]. Journal of Root Crops, 1990, 16: 48-50. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=8af3982881021ea62339fcdf98cf4996
[7] 方辉, 张惠琴, 陈孝赏, 等.双炔酰菌胺防治红香芋疫病的效果及应用技术[J].浙江农业科学, 2016, 57(6): 899 -900, 911. http://d.old.wanfangdata.com.cn/Periodical/zjnykx201606033 FANG H, ZHANG H Q, CHEN X S, et al.Effect and application technology of mandipropamid in control taro phytophthora blight[J]. Journal of Zhejiang Agricultural Sciences, 2016, 57(6):899-900, 911.(in Chinese) http://d.old.wanfangdata.com.cn/Periodical/zjnykx201606033
[8] 莫俊杰, 胡汉桥, 梁钾贤, 等.芋疫病抗病性鉴定及不同品系遗传多样性分析[J].广东海洋大学学报, 2012, 32(4): 67-72. http://d.old.wanfangdata.com.cn/Periodical/zjhydxxb201204014 MO J J, HU H Q, LIANG J X, et al.Resistance identification of taro to Phytophthora colocasiae and genetic diversity analysis of Colocasia esculenta[J]. Journal of Guangdong Ocean University, 2012, 32(4): 67-72.(in Chinese) http://d.old.wanfangdata.com.cn/Periodical/zjhydxxb201204014
[9] NATH V S, SENTHIL M, HEGDE V M, et al.Evaluation of fungicides on Indian isolates of Phytophthora colocasiae causing leaf blight of taro[J]. Archives of Phytopathology and Plant Protection, 2013, 46(5): 548-555. DOI: 10.1080/03235408.2012.749688
[10] LIN M J, KO W H.Occurrence of isolates of Phytophthora coloscsiae in Taiwan with homothallic behavior and its significance[J]. Mycologia, 2008, 100(5): 727-734. DOI: 10.3852/08-070
[11] 叶泉清, 钟佳铃, 陈媚, 等.槟榔芋疫霉菌生物学特性、致病力测定及田间防治药剂筛选[J].南方农业学报, 2016, 47(4): 588-593. DOI: 10.3969/j:issn.2095-1191.2016.04.588 YE Q Q, ZHONG J L, CHEN M, et al.Biological characteristics, virulence of Phytophthora colocasiae Racib.From Colacasia esculenta L.var. cormosus Chang and fungicides screening for field control[J]. Journal of Southern Agriculture, 2016, 47(4): 588-593.(in Chinese) DOI: 10.3969/j:issn.2095-1191.2016.04.588
[12] NATH V S, HEGDE V M, JEEVA M L, et al.Rapid and sensitive detection of Phytophthora colocasiae responsible for the taro blight using conventional and real-time PCR assay[J]. FEMS Micobiology Letters, 2014, 352: 174-183. DOI: 10.1111/fml.2014.352.issue-2
[13] MARTIN F N, ABAD Z G, BALCI Y, et al.Identification and detection of Phytophthora: reviewing our progress, identifying our needs[J]. Plant Disease, 2012, 96(8): 1080-1103. DOI: 10.1094/PDIS-12-11-1036-FE
[14] ROLLINS L, COSTS K, ELLIOTT M, et al.Comparison of five detection and quantification methods for Phytophthora ramorum in stream and irrigation water[J]. Plant Disease, 2016, 100(6): 1202-1211. DOI: 10.1094/PDIS-11-15-1380-RE
[15] 王晓杰, 康振生, 黄丽丽.PCR技术在植物病害检测中的应用[J].云南农业大学学报, 2005, 20(2): 179-182. DOI: 10.3969/j.issn.1004-390X.2005.02.006 WANG X J, KANG Z S, HUANG L L.Application of PCR technology on the detection of plant disease[J]. Journal of Yunnan Agricultural University, 2005, 20(2): 179-182.(in Chinese) DOI: 10.3969/j.issn.1004-390X.2005.02.006
[16] DRENTH A, WAGELS G, SMITH B, et al.Development of a DNA-based method for detection and identification of Phytophthora species[J]. Australasian Plant Pathology, 2005, 35: 147-159. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=f29b87735298dd378bc7471b766c4cc1
[17] 李依韦, 银玲.rDNA-ITS序列分析在植物病原真菌分类鉴定中的应用[J].内蒙古民族大学学报(自然科学版), 2012, 27(1): 66-67. DOI: 10.3969/j.issn.1671-0185.2012.01.021 LI Y W, YIN L.Application of rDNA-ITS sequences in plant disease fungi classification and identification[J]. Journal of Inner Mongolia University for Nationalities (Natural Sciences), 2012, 27(1): 66-67.(in Chinese) DOI: 10.3969/j.issn.1671-0185.2012.01.021
[18] 傅华英, 葛丹凤, 李晓燕, 等.甘蔗赤条病菌巢式PCR检测[J].植物保护学报, 2017, 44(2): 276-282. http://d.old.wanfangdata.com.cn/Periodical/zwbhxb201702014 FU H Y, GE D F, LI X Y, et al.Nested-PCR detection of Acidovorax avenae subsp.avenae, the pathogen of red stripe on sugarcane[J]. Journal of Plant Protection, 2017, 44(2): 276-282.(in Chinese) http://d.old.wanfangdata.com.cn/Periodical/zwbhxb201702014
[19] KONIG S, SCHWENKBIER L, POLLOK S, et al.Potential of Ypt1 and ITS gene regions for the detection of Phytophthora species in a lab-on-a-chip DNA hybridization array[J]. Plant Pathology, 2015, 64: 1176-1189. DOI: 10.1111/ppa.2015.64.issue-5
[20] LAN C Z, LIU P Q, LI B J, et al.Development of a specific PCR assay for the rapid and sensitive detection of Phytophthora capsici[J]. Australasian Plant Pathology, 2013, 42: 379-384. DOI: 10.1007/s13313-012-0185-8
[21] 杨万风, 刘艳, 刘翔, 等.巢式PCR检测菜豆细菌性萎蔫病菌[J].浙江农业学报, 2015, 27(7): 1202-1207. DOI: 10.3969/j.issn.1004-1524.2015.07.15 YANG W F, LIU Y, LIU X, et al.Detection of Curtobacterium flaccumfaciens pv.flaccumfaciens using nested PCR[J]. Acta Agriculturae Zhejiangensis, 2015, 27(7): 1202-1207.(in Chinese) DOI: 10.3969/j.issn.1004-1524.2015.07.15
[22] ZHANG Z G, LI Y Q, FAN H, et al.Molecular detection of Phytophthora capsici in infected plant tissues, soil and water[J]. Plant Pathology, 2006, 55(6): 770-775. DOI: 10.1111/ppa.2006.55.issue-6
[23] 赵杰.ITS序列分析及其在植物真菌病害分子检测中的应用[J].陕西农业科学, 2004(4): 35-37. DOI: 10.3969/j.issn.0488-5368.2004.04.016 ZHAO J.ITS sequence analysis and its application in molecular detection of plant fungal diseases[J]. Shanxi Journal of Agricultural Sciences, 2004(4): 35-37.(in Chinese) DOI: 10.3969/j.issn.0488-5368.2004.04.016
[24] SCHENA L, COOKE D E L.Assessing the potential of regions of the nuclear and mitochondrial genome to develop a "molecular tool box" for the detection and characterization of Phytophthora species[J]. Journal of Microbiological Methods, 2006, 67: 70-85. DOI: 10.1016/j.mimet.2006.03.003
[25] VOLOSSIOUK T, ROBB E J, NAZAR R N.Direct DNA extraction for PCR-mediated assays of soil organisms[J]. Applied and Enviromental Microbiology, 1995, 61(11): 3972-3976. http://d.old.wanfangdata.com.cn/OAPaper/oai_pubmedcentral.nih.gov_167704
-
期刊类型引用(6)
1. 刘成龙,范旭东,任芳,张尊平,胡国君,董雅凤. 苹果病毒检测技术. 园艺学报. 2024(07): 1580-1594 .  百度学术
百度学术
2. 魏雪莲,包红玉,李继姬,施慧,陶震,段鑫冰,叶莹莹,郭宝英. 超灵敏高特异性巢式PCR检测方法的建立及其在大黄鱼(Larimichthys crocea)弧菌病早期预警中的应用. 海洋与湖沼. 2024(04): 1008-1018 .  百度学术
百度学术
3. 王荣波,石茗月,徐月华,刘裴清,卞润恬,翁启勇,李本金. 福建省芋疫霉交配型测定及防治药剂筛选. 福建农业学报. 2024(07): 810-818 .  本站查看
本站查看
4. 殷丽华,张金鹏,章国庆,刘国辉,柯希望,左豫虎. 小豆锈病分子检测体系的构建及应用. 干旱地区农业研究. 2023(06): 238-244 .  百度学术
百度学术
5. 王荣波,陈姝樽,赵玉梅,李本金,刘裴清,陈庆河. 芋疫霉重组聚合酶扩增结合侧流层析试纸条快速检测方法的建立及应用. 植物保护学报. 2022(06): 1654-1662 .  百度学术
百度学术
6. 李得铭,翟子翔,邓涛,邓大豪,周游,黄俊生. 番茄青枯菌分离与三重PCR体系建立. 分子植物育种. 2020(11): 3655-3661 .  百度学术
百度学术
其他类型引用(3)




 下载:
下载: