ITS-based Phylogeny of Dimocarpus confinis
-
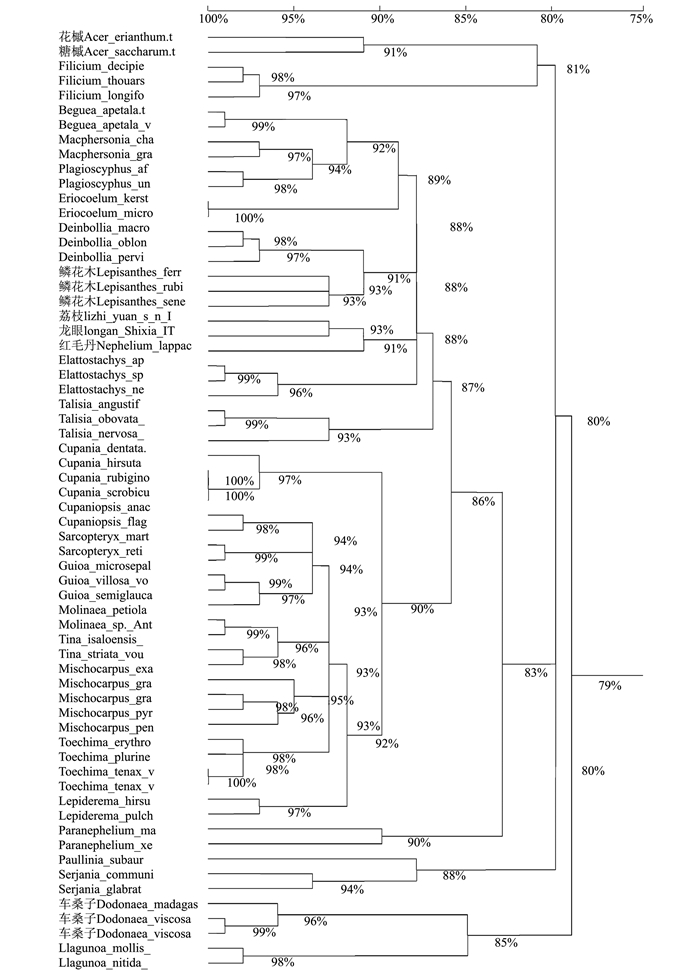
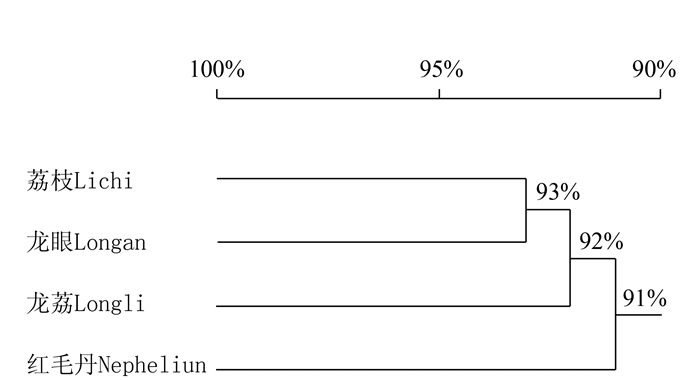
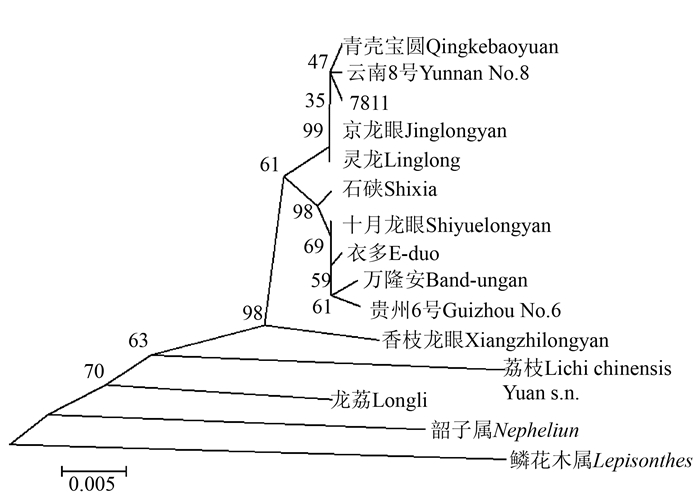
摘要:目的 利用无患子科间隔转录区序列(ITS)探讨了龙荔的系统发育地位。方法 通过无患子科27个属62个种ITS序列信息序列比对和系统发育分析,探讨龙荔和龙眼、荔枝之间的系统进化关系。结果 基于ITS序列信息可以清楚区分无患子科内不同的种属,其属间ITS序列相似度为(91.0±4.4)%、种间为(96.3±2.8)%。龙荔与龙眼、荔枝之间的ITS序列同源性均为92%,低于龙眼与荔枝间的同源性(93%),但高于和红毛丹的同源性(91%),其ITS序列中有4.5%的碱基位点与龙眼和荔枝均不同,主要表现为T和C互换、A和G互换,共占序列差异位点的56.5%。以韶子属红毛丹为外类群的系统发育树显示,龙荔、荔枝、龙眼之间的进化发育明显,龙荔最早自成分支,其次是荔枝,最后是龙眼。结论 ITS序列信息分析结果支持龙荔作为独立属的分类可能。Abstract:Objective To establish the phylogeny of longli, Dimocarpus confinis, based on its nuclear encoded internal transcribed spacer (ITS) sequences.Method The ITS sequences of 27 genera and 62 species of Sapindaceae were collected to examine the relationship among longli, longan (Dimocarpus longan) and litchi (Litchi chinensis).Result The genera in Sapindaceae family could be clearly classified by ITS sequence. The homology among the genera was(91.0±4.4)%, and among the species (96.3±2.8)%. The ITS sequence homology between longli and longan or litchi was 92%, which was lower than that between longan and litchi at 93% but higher than that between longli and rambutan (Nephelium lappaceum L.) at 91%. Four and half percent of the longli ITS sequence differed from those of longan and litchi. The differences were mainly changing between T and C or A and G that accounted for 56.5% of the total. Based on the phylogenetic tree of rambutan as the outgroup, the evolution of longli was shown to be the earliest to branch out, followed by litchi and longan.Conclusion The result suggested classifying longli as a separate genus in the family.
-
Keywords:
- Dimocarpus confinis /
- pylogeny /
- ITS sequence
-
0. 引言
【研究意义】大花金挖耳Carpesium macrocephalum Franch.et Sav.又名香油罐、神灵草,属于菊科Compositae天名精属Carpesium多年生草本植物,在我国陕西、甘肃南部、四川北部、东北、华北等地的山坡灌丛及混交林缘有分布[1]。KIM等[2]、YANG C等[3]、王俊儒等[4]从大花金挖耳分离鉴定得到黄酮类、萜类、香豆素等化合物近100种,大花金挖耳具有抗肿瘤、止血等医用价值[1, 5]和杀菌、杀虫及除草等多种农药活性[6-8],目前尚无人工引种栽培。大花金挖耳及天名精属同属植物多含黄酮、酚类、萜类、甾体、脂肪酸及苯的衍生物等多种化合物,药用价值高[9],极具开发价值。【前人研究进展】为了缓解大花金挖耳及同属植物资源保护与利用的矛盾, 以及黄酮等生物活性物质人工合成的困难[10-11],利用植物细胞培养技术生产大花金挖耳活性成分是一种有效方法[12]。研究表明,铁Fe、锰Mn、锌Zn、铜Cu、钼Mo、硼B和钴Co等微量元素对植物细胞培养次生代谢产物具有重要的作用[13-15]。【本研究切入点】截至目前,国内外尚无微量元素影响大花金挖耳悬浮细胞黄酮生物合成的研究。【拟解决的关键问题】本文在摇瓶液体悬浮培养条件下, 研究了大花金挖耳细胞培养基中添加不同浓度Mn2+、Zn2+、Co2+、Cu2+、Fe2+、I-、BO33-、MoO42-等8种微量元素[16]对大花金挖耳悬浮培养细胞的生长和黄酮生物合成的影响,并测试了大花金挖耳悬浮培养细胞的乙醇粗提物对苘麻、鬼针草2种常见杂草和黄瓜、黄豆2种食用植物的化感作用, 试验结果为大规模细胞培养大花金挖耳活性物质奠定了基础。
1. 材料和方法
1.1 试验材料
1.1.1 受体植物
苘麻Abutilon theophrasti和鬼针草Bidens pilosa植物种子采自西北农林科技大学试验农场。黄瓜种子(Cucumis sativus,品种为西农58)和黄豆种子Glycine max购自陕西杨陵种子市场。
1.1.2 试剂
芦丁标准品(中国药品生物制品检定所);萘乙酸(NAA)、6-苄氨基嘌呤(6-BA) (美国Sigma公司);培养基中添加的蔗糖、肌醇、盐酸硫胺素(VB1)及各种微量元素化合物均为分析纯;丙酮、乙醇为分析纯。
1.2 试验方法
1.2.1 细胞培养方法
大花金挖耳悬浮细胞系[12]继代培养于NT+1.0 mg·L-1 NAA+0.2 mg·L-1 6-BA培养基中,继代培养3代后,接种约40 g·L-1鲜重于不同试验处理的NT培养基中进行悬浮培养。培养条件为:摇床转速120r·min-1、(25±2)℃、光照强度1 500~2 000 lx、光照12 h·d-1,蔗糖4%、培养基高压灭菌前pH调至5.8, 所有试验重复3次。试验采用250 mL三角瓶, 每瓶盛100 mL培养基。
1.2.2 8种微量元素对大花金挖耳细胞生长和黄酮类化合物累积的影响
以NT为基本培养基,通过加减改变NT培养基中8种微量元素的浓度,分别考察微量元素对悬浮培养细胞的生长和黄酮类化合物累积的影响,并以NT培养基中Zn2+、Mn2+、Co2+、Cu2+、Fe2+、I-、BO33-、MoO42-等8种微量元素固有的浓度[16]为对照。Zn2+在NT培养基中的浓度设置为0.03(CK)、0.06、0.12、0.18、0.3 mmol·L-1;Mn2+在NT培养基中的浓度依次为0.1(CK)、0.2、0.4、0.6、0.8 mmol·L-1;Co2+在NT培养基中的浓度依次为0.05、0.1(CK)、0.2、0.3、0.5、0.7 μmol·L-1;Cu2+在NT培养基中的浓度依次为0.1、0.2(CK)、0.4、0.6、0.8 μmol·L-1;Fe2+在NT培养基中的浓度依次为0.05、0.1(CK)、0.2、0.3、0.4 mmol·L-1;I-在NT培养基中的浓度依次为5(CK)、10、15、20、25、30 μmol·L-1;BO33-在NT培养基中的浓度依次为0.1(CK)、0.2、0.4、0.6、1.0 mmol·L-1;MoO42-在NT培养基中的浓度依次为1.0(CK)、2.0、3.0、4.0、5.0、6.0 μmol·L-1。各处理均设3次重复。
1.2.3 生物量的测定
将上述不同处理悬浮培养20 d的褐化细胞进行抽滤,所得细胞置于60℃烘箱中,烘至恒重,以细胞干重(g·L-1)为生长指标, 细胞净生长量=收获时细胞干重-接种时细胞干重。
1.2.4 黄酮含量的测定和产量的计算
采用分光光度法测定总黄酮含量[12]。以芦丁为标准品,绘制标准曲线,确定检测波长为510 nm,以芦丁的浓度C(mg·mL-1)对吸光值A进行线性回归,得回归方程C=0.0768 A-0.0004,r=0.999 7。将上述各试验处理中培养20 d的褐化细胞抽滤、烘干、粉碎, 过60目筛后,取适量细胞干粉, 以丙酮为溶剂,摇床振荡提取3次, 每次24 h,合并3次所得提取液, 浓缩后用30%乙醇定容至0.50 g·mL-1。移取适量供试液, 在510 nm下测定其吸光值,按公式计算总黄酮含量(X),X% = V×Y/N×M×10-1,V为提取液体积(mL),Y为供试液总黄酮质量浓度(mg·mL-1),N为样品质量(g),M为稀释倍数。悬浮培养细胞总黄酮产量(mg·L-1) =黄酮含量(%)×细胞生长量(g·L-1)×1000。
1.2.5 幼苗生长的生物测定
采用幼苗生长法[17]测试悬浮培养细胞粗提物对苘麻、鬼针草、黄瓜和黄豆等4种受体植物幼苗根生长的化感作用。将悬浮培养于NT+1.0 mg·L-1NAA +0.2 mg·L-1 6-BA中(NT培养基中微量元素为固有浓度[16])20 d的褐化细胞抽滤、烘干、粉碎、过筛(60目), 取适量细胞干粉, 乙醇提取减压浓缩成浸膏,以超声波促溶,配制不同浓度的蒸馏水溶液, 在铺有2层滤纸、直径9 cm的培养皿中等量均匀加入2.5 mL供试蒸馏水溶液, 并将供试种子催芽后,均匀置入皿中,进行化感测定, 以蒸馏水处理作对照。各处理均置于(25±2)℃温室中暗光培养, 其间适量补充水分, 2 d后测定受体植物种子幼苗根生长的平均长度, 按公式IR=(CK- T)/CK(CK为对照值,T为处理值)计算化感抑制率(IR)。用最小二乘法得出供试溶液的毒力回归方程、相关系数(R)、抑制中浓度(EC50)和95%置信限。
1.3 数据统计与分析
采用DPS数据分析软件对试验数据进行Duncan分析(P=0.05)。
2. 结果与分析
2.1 不同微量元素对悬浮培养细胞的生长和黄酮类化合物累积的影响
2.1.1 Zn2+离子对悬浮培养细胞的生长和黄酮类化合物累积的影响
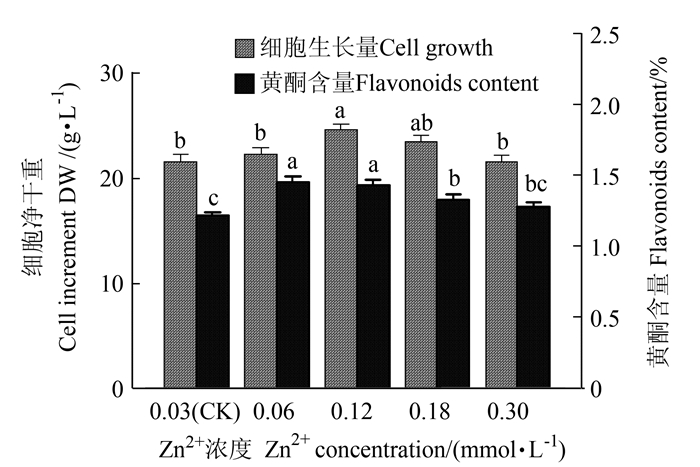
如图 1所示,NT培养基中,Zn2+离子浓度在0.03~0.30 mmol·L-1范围内增加时,对大花金挖耳悬浮培养细胞黄酮生物合成有显著影响,细胞生长量和黄酮含量表现为先增后降。就细胞生长而言,0.03~0.3 mmol·L-1 Zn2+浓度均适于细胞的生长,其中Zn2+浓度0.12 mmol·L-1时,细胞生长显著增加,净生长量最高,达24.55 g·L-1,是对照的1.13倍。随Zn2+浓度的增加,培养基中细胞黄酮含量增大,Zn2+浓度0.06 mmol·L-1时,细胞黄酮含量最大为1.46%,是对照的1.20倍(P < 0.05);Zn2+浓度0.12 mmol·L-1时,培养基细胞黄酮产量达最高值382 mg·L-1(P < 0.05),是对照的1.33倍。
![]() 图 1 锌离子对悬浮培养细胞生长和黄酮含量的影响注:图中不同字母表示不同处理在0.05水平存在显著差异(P < 0.05),下同。Figure 1. Effects of Zn2+ concentration on cell growth and flavonoids content in suspension cultureNote:Different lowercase letters on columns indicate significant difference between treatments at P < 0.05.The same as following charts.
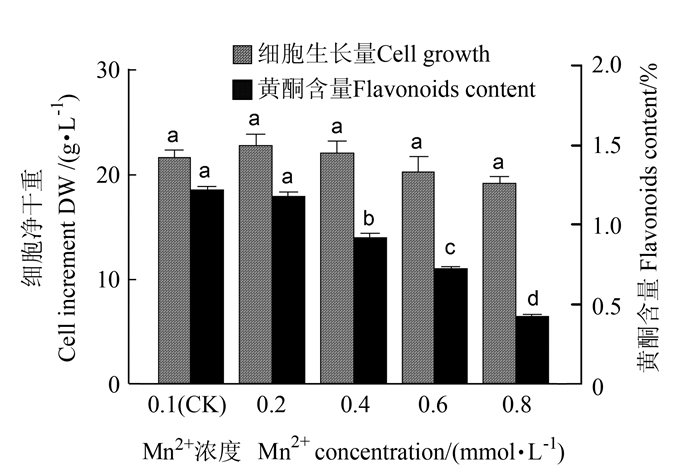
图 1 锌离子对悬浮培养细胞生长和黄酮含量的影响注:图中不同字母表示不同处理在0.05水平存在显著差异(P < 0.05),下同。Figure 1. Effects of Zn2+ concentration on cell growth and flavonoids content in suspension cultureNote:Different lowercase letters on columns indicate significant difference between treatments at P < 0.05.The same as following charts.2.1.2 Mn2+离子对悬浮培养细胞的生长和黄酮类化合物累积的影响
如图 2所示,Mn2+浓度在0.1~0.8 mmol·L-1范围内增加时,悬浮培养细胞的净生长量先增后降,但影响不显著,维持在19.16~22.76 g·L-1,其中Mn2+浓度在0.1~0.8 mmol·L-1范围内适于细胞的生长,浓度过高不利于细胞的生长。随着Mn2+浓度在0.1~0.8 mmol·L-1范围内增加,大花金挖耳悬浮培养细胞中黄酮类化合物累积显著降低,从1.22%下降到0.43%,高浓度Mn2+不适于细胞黄酮的生物合成,黄酮产量以Mn2+浓度0.1~0.2 mmol·L-1时较高,其中Mn2+浓度0.2 mmol·L-1时, 黄酮产量最大,为291.28 mg·L-1,是对照的1.01倍。
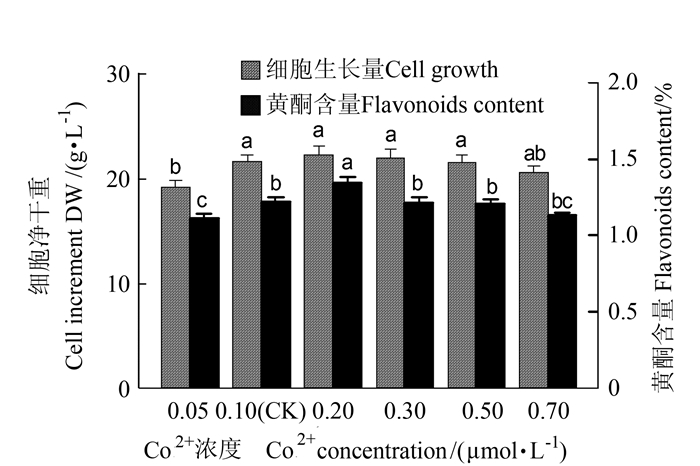
2.1.3 Co2+离子对悬浮培养细胞的生长和黄酮类化合物累积的影响
如图 3所示,Co2+在0.05~0.7 μmol·L-1浓度范围内增加时,对大花金挖耳悬浮培养细胞黄酮生物合成有显著影响,细胞生长量和黄酮含量呈先增后降的趋势。就细胞生长而言,0.1~0.7 μmol·L-1 Co2+浓度均适于细胞的生长,其中Co2+浓度0.2 μmol·L-1时,细胞净生长量最高,达24.55 g·L-1,是对照的1.03倍。培养基中随Co2+浓度的增加,细胞黄酮含量先升后降,Co2+浓度0.2 μmol·L-1时,细胞黄酮含量最高达1.35%,是对照的1.11倍(P < 0.05),该浓度下细胞黄酮产量最高,达327.34 mg·L-1,是对照1.14倍。
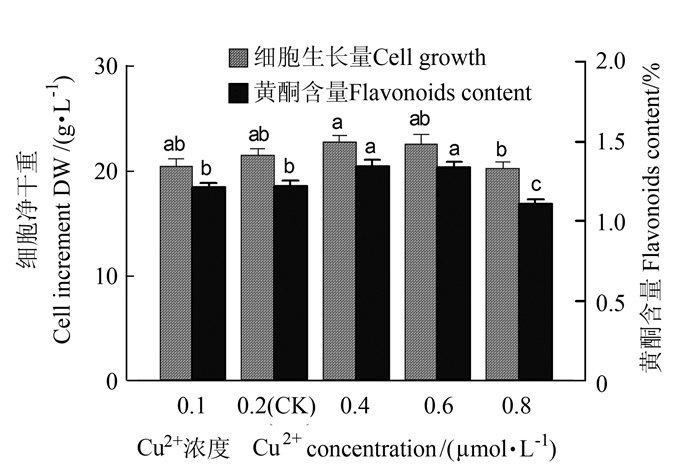
2.1.4 Cu2+离子对悬浮培养细胞的生长和黄酮类化合物累积的影响
如图 4所示,Cu2+在0.1~0.8 μmol·L-1浓度范围内变化时,对悬浮培养细胞的生长和黄酮生物合成均有显著影响,细胞生长量和黄酮含量呈先增后降的趋势。Cu2+浓度0.4 μmol·L-1时,细胞净生长量显著增大,高达22.95 g·L-1,是对照的1.10倍。随培养基中Cu2+浓度的增加,细胞黄酮含量先升后降,Cu2+浓度0.4 μmol·L-1时,细胞黄酮含量最高,达1.35%,是对照的1.11倍(P < 0.05),培养基细胞黄酮产量最高,达337.82 mg·L-1,是对照1.16倍。
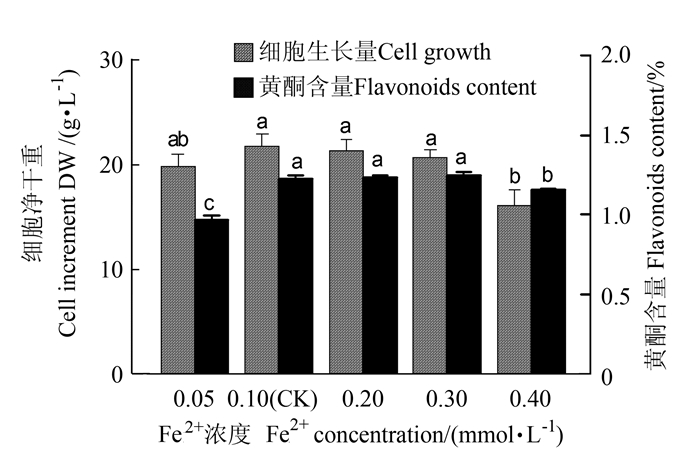
2.1.5 Fe2+离子对悬浮培养细胞的生长和黄酮类化合物累积的影响
如图 5所示,Fe2+浓度在0.05~0.4 mmol·L-1范围内增加时,对大花金挖耳悬浮培养细胞生长和黄酮生物合成影响显著,细胞净生长量和黄酮含量先增后降,随Fe2+浓度的增加,细胞褐化严重。Fe2+浓度在0.1~0.3 mmol·L-1时,细胞净生长量、黄酮含量和产量都达到稳定高值,细胞净生长量维持在20.53~21.61 g·L-1,黄酮含量维持在1.22~1.24%,黄酮产量维持在279.33~288.89 mg·L-1,以Fe2+浓度在0.1 mmol·L-1(对照)时,黄酮产量最高。
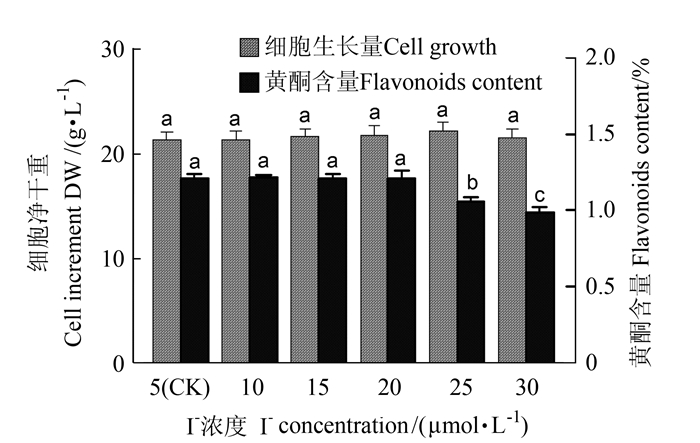
2.1.6 I-离子对悬浮培养细胞的生长和黄酮类化合物累积的影响
如图 6所示,在NT培养基添加KI时,当I-浓度在5~30 μmol·L-1范围内变化时,对悬浮培养细胞的生长影响不显著,但对细胞黄酮类化合物含量的影响显著。培养基中I-浓度在5~20 μmol·L-1范围内,黄酮含量变化不大,黄酮产量稳定,维持在288.69~293.90 mg·L-1,I-浓度在25~30 μmol·L-1范围内继续加大时,黄酮含量显著下降。
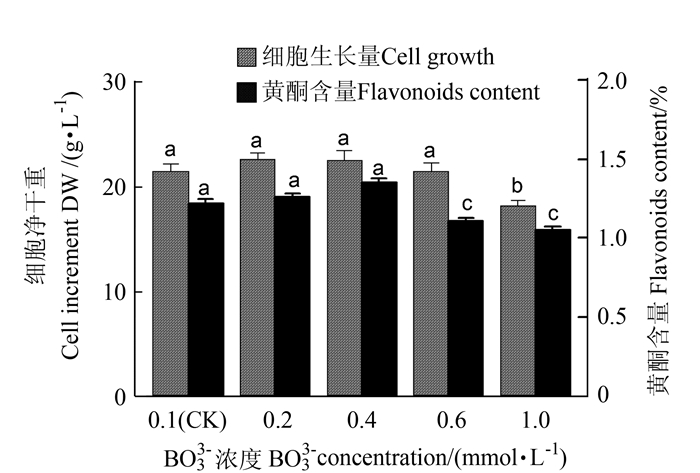
2.1.7 BO33-离子对悬浮培养细胞的生长和黄酮类化合物累积的影响
如图 7所示,当NT培养基中BO33-浓度在0.1~0.6 mmol·L-1范围内,细胞生长良好,当BO33-浓度在0.2 mmol·L-1时,细胞净生长量高达22.75 g·L-1,是对照的1.05倍。随培养基中BO33-浓度的增加,黄酮含量先升后降,高浓度的BO33-不利于细胞生长和黄酮合成,当BO33-浓度在0.4 mmol·L-1时,细胞黄酮含量和产量最高,分别达1.35%和333.76 mg·L-1,分别是对照的1.11和1.16倍。
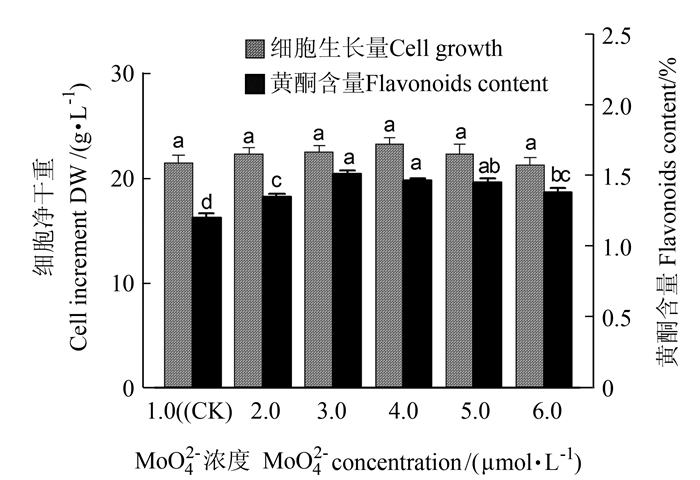
2.1.8 MoO42-离子对悬浮培养细胞的生长和黄酮类化合物累积的影响
由图 8可知,在NT培养基中MoO42-在1.0~6.0 μmol·L-1时,对悬浮培养细胞的生长和黄酮生物合成均有显著影响。就细胞生长而言,MoO42-浓度1.0~6.0 μmol·L-1均适于细胞的生长,其中含4.0 μmol·L-1 MoO42-浓度的培养基细胞净生长量高, 达23.48 g·L-1,是对照的1.08倍。随培养基中MoO42-浓度的增加,黄酮含量先增后降,含3.0 μmol·L-1 MoO42-浓度的培养基细胞黄酮含量最高达1.53%,是对照的1.25倍,含3.0~4.0 μmol·L-1 MoO42-浓度的培养基细胞黄酮产量达379 mg·L-1。
2.2 大花金挖耳培养细胞的乙醇粗提物对供试4种植物幼苗根的生长抑制作用
由表 1可见, 大花金挖耳悬浮培养细胞的乙醇粗提物对4种供试植物幼苗根的生长均有不同的抑制作用,并随粗提物水溶液浓度的升高,种子幼根生长抑制率增大。细胞粗提物对4种供试植物幼苗根生长的抑制中浓度(EC50)在14.69~59.07 mg·mL-1,EC50值的大小顺序依次为:黄豆、苘麻、黄瓜、鬼针草,对黄豆的毒力最低, EC50值为59.07 mg·mL-1, 对鬼针草的毒力最大, EC50值为14.69 mg·mL-1。
表 1 大花金挖耳培养细胞的粗提物对4种供试植物幼苗根生长的毒力(2 d)Table 1. Virulence of crude extracts from C. macrocephalum culture on root growth of plant seedlings(2 d)供试种子
Tested seeds毒力回归线
Regression equation有效中浓度/(mg·mL-1)
EC50(95%CL)相关系数
R苘麻(根)Root of A.theohprasti Y=-2.3061+5.6291 X 19.8571(10.0363~39.2878) 0.9971 鬼针草(根)Root of B.bipinnata Y=3.3295+1.4313 X 14.6940(9.3904~22.9931) 0.9640 黄瓜(根)Root of C.sativus Y=3.6709+1.0389 X 19.0260(12.2396~29.5752) 0.9522 黄豆(根)Root of G.max Y=3.7408+0.7109 X 59.0704(49.8513~69.9943) 0.9914 注:Y表示生长抑制率的几率值;X表示粗提物质量浓度的对数值。
Note:Y is probability of growth inhibition rate and X logarithmic mass concentration of crude extracts.3. 讨论与结论
微量元素虽然含量较少,但大多是酶的组成成分或活化剂,在植物细胞代谢过程中与大量元素一样具有很重要的作用[18-20]。本研究发现8种微量元素对大花金挖耳悬浮培养细胞黄酮类化合物的生物合成有显著影响。Co2+、Cu2+分别为培养基原浓度2倍、BO33-和MoO42-分别为培养基原浓度4倍时,黄酮生物合成显著增加,黄酮含量在各处理中最高,高浓度的Mn2+、I-导致大花金挖耳悬浮培养细胞黄酮含量降低,说明在培养基中适量添加这些微量元素有利于大花金挖耳细胞的生长和黄酮的生物合成,但过高浓度的微量元素会导致黄酮生物合成下降。Fe2+在多种氧化还原反应中发挥着重要作用,与Cu2+、Mn2+、Zn2+等离子具有拮抗作用,培养基中Fe2+浓度过高会抑制细胞吸收Cu2+、Mn2+、Zn2+等微量元素,从而抑制一些酶的活性而对细胞的生长和次生代谢物积累产生很大的影响[21-22]。其可能的机理是:在细胞培养中,微量元素具有重要的生理作用,微量元素通过独立或相互作用影响着大花金挖耳悬浮细胞的光合、呼吸、氮代谢等初生代谢,进而影响黄酮类等化合物的次生代谢。如锰是许多酶的活化剂,在光合反应中发挥着重要的作用[21, 23];锌存在于许多不同植物细胞的蛋白质中,是呼吸作用的一个重要因素,缺锌和铁会造成悬浮细胞呼吸速率下降[24],研究发现NT培养基中微量元素Zn2+对大花金挖耳细胞黄酮产量的影响最大;钴能改善植物的生长、蒸腾及光合作用;铜具有多种氧化还原功能,能催化植物氧化还原反应[21];硼与细胞膜的功能关系密切,有影响细胞质膜上NADH氧化酶活性和质子分泌的作用,从而对悬浮细胞的生长造成影响[24];钼是氧化酶的辅酶,可促进光合作用强度[25]。研究结果为进一步优化培养基成分和培养条件,提高大花金挖耳细胞悬浮培养活性物质奠定了基础。
植物化感作用是通过向环境中释放代谢物质,并主要影响植物种子萌发及幼苗生长,形成不同植物在化学方面的相互作用,协调植物与环境的关系[26]。已知黄酮类化合物具有植物化学防御、化感作用和抗氧化等作用[27]。本研究发现大花金挖耳悬浮细胞的胞内代谢产物对4种受体植物具有不同程度的化感作用,这可能与细胞代谢中产生的黄酮等物质有关。研究结果为进一步分离大花金挖耳细胞悬浮培养农药活性物质奠定了基础,为有效控制田间杂草、牧草混播和粮食作物的保护和农林复合系统的合理构建及优化提供了新的试验依据。
-
表 1 ITS序列分析用植物材料
Table 1 Plant materials employed for ITS analysis
序号
No.属
Genus基因编号
Genebank number1 毛花槭Acer erianthum EU720501.1 2 糖槭Acer saccharum EU720502.1 3 Beguea apetala EU720512.1 4 Beguea apetala EU720491.1 5 Cupania dentata EU720523.1 6 Cupania hirsuta EU720521.1 7 Cupania rubiginosa EU720481.1 8 Cupania scrobiculata EU720524.1 9 Cupaniopsis anacardioides EU720438.1 10 Cupaniopsis flagelliformis EU720432.1 11 Deinbollia macrocarpa EU720503.1 12 Deinbollia oblongifolia EU720427.1 13 Deinbollia pervillei EU720395.1 14 车桑子Dodonaea madagascariensis EU720518.1 15 车桑子Dodonaea viscosa EU720536.1 16 车桑子Dodonaea viscosa EU720519.1 17 Elattostachys EU720538.1 18 Elattostachys nervosa EU720455.1 19 Elattostachys sp. EU720529.1 20 Eriocoelum kerstingii EU720539.1 21 Eriocoelum microspermum EU720540.1 22 Filicium decipiens 23 Filicium longifolium EU720466.1 24 Filicium thouarsianum EU720541.1 25 Guioa microsepala EU720493.1 26 Guioa semiglauca EU720546.1 27 Guioa villosa EU720458.1 28 Lepiderema hirsuta EU720544.1 29 Lepiderema pulchella EU720435.1 30 鳞花木Lepisanthes ferruginea EU720454.1 31 鳞花木Lepisanthes rubiginosa EU720449.1 32 滇赤才Lepisanthes senegalensis EU720446.1 33 Llagunoa mollis EU720492.1 34 Llagunoa nitida EU720482.1 35 Macphersonia chapelieri EU720486.1 36 Macphersonia gracilis EU720459.1 37 Mischocarpus exangulatus EU720550.1 38 Mischocarpus grandissimus EU720437.1 39 Mischocarpus pentapetalus EU720470.1 40 Mischocarpus pyriformis EU720460.1 41 Molinaea petiolaris EU720554.1 42 Molinaea sp. EU720.510.1 43 红毛丹Nephelium lappaceum EU720401.1 44 Paranephelium macrophyllum EU720451.1 45 Paranephelium xestophyllum EU720420.1 46 Paullinia subauriculata EU720494.1 47 Plagioscyphus aff. EU720555.1 48 Sarcopteryx martyana EU720426.1 49 Sarcopteryx reticulata EU720421.1 50 Serjania communis EU720472.1 51 Serjania glabrata EU720557.1 52 Talisia angustifolia EU720558.1 53 Talisia nervosa EU720474.1 54 Talisia obovata EU720485.1 55 Tina isaloensis EU720520.1 56 Tina striata EU720509.1 57 Toechima erythrocarpum EU720431.1 58 Toechima plurinerve EU720452.1 59 Toechima tenax EU720456.1 60 Toechima erythrocarpum EU720431.1 61 Toechima plurinerve EU720452.1 62 Toechima tenax EU720456.1 63 荔枝Litchi chinensis Yuan s.n. EU720400.1 64 7811龙眼Dimocarpus longan vary 7811 EF532334.1 65 石硖龙眼Dimocarpus longan vary shixia EF488973.1 66 十月龙眼Dimocarpus longan varyshiyuelongyan EF532338.1 67 云南8号龙眼Dimocarpus longan vary yunnan No8 EF532331.1 68 贵州6号龙眼Dimocarpus longan vary guizhou No6 EF532333.1 69 灵龙龙眼Dimocarpus longan varylinglong EF532329.1 70 依多龙眼Dimocarpus longan varyEdor EF532337.1 71 香枝龙眼Dimocarpus longan vary xiangzhilongyan / 72 京龙眼Dimocarpus longan vary.jinglongyan / 73 万隆安龙眼Dimocarpus longan vary Band-ungan EF532340.1 74 青壳宝圆龙眼Dimocarpus longan.vary qingkebaoyuan EF488971.1 75 龙荔Dimocarpus confinis EF532336.1 -
[1] 邱武陵, 章恢志.中国果树志·龙眼批把卷[M].北京:中国林业出版社, 1996. QIU W L, ZHANG H Z.China Fruit Graphy:Longan and Loquat Tomus[M]. Beijing:China Forestry Publishing House, 1996.(in Chinese)
[2] 潘丽梅, 朱建华, 刘冰浩, 等.广西龙虎山自然保护区龙荔种群生命表分析[J].园艺学报, 2011, 38(7):1349-1355. http://d.old.wanfangdata.com.cn/Periodical/yyxb201107018 PAN L M, ZHU J H, LIU B H, et al.Life Table Analysis of Dimocarpus confinis Population in Guangxi Longhushan Nature Reserve[J]. Acta Horticulturae Sinica, 2011, 38(7):1349-1355.(in Chinese) http://d.old.wanfangdata.com.cn/Periodical/yyxb201107018
[3] 陈秀萍, 蒋际谋, 许家辉, 等.不同砧木对龙眼生长的影响试验[J].中国南方果树, 2006, 35(5):21-22. DOI: 10.3969/j.issn.1007-1431.2006.05.013 CHE X P, JIANG J M, XU J H, et al.Reseach of longan development based on different storcks[J]. South China Fruits, 2006, 35(5):21-22.(in Chinese) DOI: 10.3969/j.issn.1007-1431.2006.05.013
[4] 陆贵锋, 朱松生, 黄川, 等.龙荔嫁接龙眼、荔枝的试验初报[J].中国南方果树, 2016, 45(5):148-149. http://www.cnki.com.cn/Article/CJFDTOTAL-FRUI201605047.htm LU G F, ZHU S S, HUANG C, et al.research of grafting between Longli and Longan and Litchi[J]. South China Fruits, 2016, 45(5):148-149.(in Chinese) http://www.cnki.com.cn/Article/CJFDTOTAL-FRUI201605047.htm
[5] 刘冰浩, 徐宁, 朱建华, 等.广西龙眼种质耐寒性的CTR值鉴定[J].西南农业学报, 2006, 19(4):668-671. DOI: 10.3969/j.issn.1001-4829.2006.04.029 LIU B H, XU N, ZHU J H, et al.The CTR identification of chilling-tolerance of Longan germplasm in Guangxi[J]. Southwest China Journalof Agricultural Science, 2006, 19(4):668-671.(in Chinese) DOI: 10.3969/j.issn.1001-4829.2006.04.029
[6] 姜帆, 高慧颖, 陈秀萍, 等.龙眼属rDNA的ITS序列分析[J].果树学报, 2008, 25(2): 262- 268. http://d.old.wanfangdata.com.cn/Periodical/gskx200802024 JIANG F, GAO H Y, CHE X P, et al.Analysis of ITS sequences of rDNA in Dimocarpus plants[J]. Journalof Fruit Science, 2008, 25(2): 262- 268.(in Chinese) http://d.old.wanfangdata.com.cn/Periodical/gskx200802024
[7] 高慧颖, 姜帆, 陈秀萍, 等.不同地域的代表性基因型龙眼RAPD分析[J].福建林业科技, 2007, 34(1): 67-71, 88. DOI: 10.3969/j.issn.1002-7351.2007.01.017 GAO H Y, JIANG F, CHE X P, et al.Random Amplification Polymorphic DNA (RAPD) Analysis of the Typical Longan Genotypes from Different Origins[J]. Journal of Fujian Forestry Science and Technology, 2007, 34(1): 67-71, 88.(in Chinese) DOI: 10.3969/j.issn.1002-7351.2007.01.017
[8] 彭宏祥, 曹辉庆, 朱建华, 等.利用AFLP分子标记对广西荔枝优稀种质遗传多样性及分类研究[J].西南农业学报, 2006, 9(1): 108-111. DOI: 10.3969/j.issn.1001-4829.2006.01.026 PENG H X, CAO H Q, ZHU J H, et al.Studies on the application of AFLP molecular markers on genetic diversity and classification of good and rare litchi resources in Guangxi[J]. Southwest China Journalof Agricultural Science, 2006, 9(1): 108-111.(in Chinese) DOI: 10.3969/j.issn.1001-4829.2006.01.026
[9] 易干军, 谭卫萍, 霍合强, 等.龙眼品种(系)遗传多样性及亲缘关系的AFLP分析[J].园艺学报, 2003, 30(3): 272-276. DOI: 10.3321/j.issn:0513-353X.2003.03.005 YI G J, TAN W P, HU H Q, et al.Studies on the Genetic Diversity and Relationship of Longan Cultivars by AFLP Analysis[J]. Acta Horticulturae Sinica, 2003, 30(3): 272-276.(in Chinese) DOI: 10.3321/j.issn:0513-353X.2003.03.005
[10] 苏伟强, 黄海滨, 陆玉英, 等.龙荔与龙眼荔枝过氧化物酶同工酶分析及亲缘关系研究初报[J].广西农业科学, 1993(4): 158-159. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=QK000000920143 SU W Q, HUANG H B, LU Y Y, et al.Studies on the Relationship of Longli and Longan by POD Analysis[J]. Agricultural Science of Guangxi, 1993(4): 158-159.(in Chinese) http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=QK000000920143
[11] ROBERT VenBUREN, et al.Longli is not a Hybrid of Longan and Lychee as Revealed by Genome Size Analysis and Trichome Morphology[J]. Tropical Plant Biology, Tropical Plant Biol, 2011, 4: 228-236.(in Chinese) DOI: 10.1007/s12042-011-9084-3
[12] 张永福, 韩丽, 黄鹤平, 等.荔枝、龙眼及龙荔的茎解剖结构比较[J].植物科学学报, 2014, 32(6): 551-560. http://d.old.wanfangdata.com.cn/Periodical/whzwxyj201406001 ZHANG YF, HAN L, HUANG HP et al.Comparisons of Stem Anatomical Structures among Litchi, Longan and Longli[J]. Plant Science Journal, 2014, 32(6): 551-560.(in Chinese) http://d.old.wanfangdata.com.cn/Periodical/whzwxyj201406001
[13] LIN T X, LIN Y, KOSHUN LSHIKI.Genetic diversity of Dimocarpus longan in China revealed by AFLP markers and partial rbcL gene sequences[J]. Scientia Horticulturae, 2005, 103(4):489-498. DOI: 10.1016/j.scienta.2004.08.005
[14] LIU C M, MEI M T.Classification of lychee cultivars with RAPD analysis[J]. Acta Horticulturae, 2005, 665: 149-159.
[15] BUERKI S, FOREST F, ACEVEDO-RODRIGUEZ P, et al.Plastid and nuclear DNA markers reveal intricate relationships at subfamilial and tribal levels in the soapberry family (Sapindaceae)[J]. Mol Phylogenet Evol, 2009, 51 (2), 238-258. DOI: 10.1016/j.ympev.2009.01.012
[16] 何婷婷, 柴军红.基于ITS基因的部分兰属序列分析[J].分子植物育种, 2017, 15(1): 52- 57. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=fzzwyz201701008 HE T T, CAI J H.Sequence Analysis of Cymbidium Based on ITS Gene[J]. Molecular Plant Breeding, 2017, 15(1): 52- 57.(in Chinese) http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=fzzwyz201701008
[17] 曹丽敏, 夏念和, 曹明, 等.中国无患子科的花粉形态及其系统学意义[J].植物科学学报, 2016, 34(6): 821-833. http://d.old.wanfangdata.com.cn/Periodical/whzwxyj201606001 CAO LM, XIA NH, CAO M, et al.Pollen Morphology and Its Systematic Significance in Sapindaceae from China[J]. Plant Science Journal, 2016, 34(6): 821-833.(in Chinese) http://d.old.wanfangdata.com.cn/Periodical/whzwxyj201606001
[18] PETKOVITS T, NAGY L G, HOFFMANN K, et al.Data Partitions, Bayesian Analysis and Phylogeny of the Zygomycetous Fungal Family Mortierellaceae, Inferred from Nuclear Ribosomal DNA Sequences[J]. PLoS ONE, 2011, 6(11): e27507. DOI: 10.1371/journal.pone.0027507
-
期刊类型引用(4)
1. 杨晓琼,范源洪,何璐,袁建民,孔维喜,许智萍. 云南热区香茅草总黄酮及矿质元素含量. 应用与环境生物学报. 2021(02): 366-373 .  百度学术
百度学术
2. 胡珊群,梁汝黛,李彤,王晨,刘长利. 药用植物悬浮细胞培养技术研究进展. 种子科技. 2021(18): 7-12 .  百度学术
百度学术
3. 黄燕芬,王自布,施琴,谢奇. 碳氮磷营养对百蕊草悬浮培养细胞生长的影响. 西南农业学报. 2021(12): 2580-2585 .  百度学术
百度学术
4. 李玉平,龚宁. 培养基主成分优化提高大花金挖耳胞内黄酮产量. 福建农业学报. 2019(06): 652-659 .  本站查看
本站查看
其他类型引用(1)




 下载:
下载: