Research on the Influencing Factors of the Profit Sharing Problem of Fujian Farmers Incubators
-
摘要: 协调与满足农民创业园利益相关者的利益诉求,建立科学合理的利益联结机制是农民创业园健康可持续发展的保证。本文基于福建农民创业园的调查数据,通过分析福建农民创业园中农户与企业两个利益主体的诉求,运用逻辑回归分析方法,分析农户、企业进行利益联结方式选择的影响因素。结果表明,从农户的视角,农户文化程度、农户全年人均收入、目标市场、农产品商品化率和农业企业销售农产品的规模对农户决策显著的正向作用,市场波动状况对农户决策具有显著的负向作用;从企业的视角,企业类型、销售额、目标市场和从农户手中收购农产品的比重对企业决策具有显著的正向作用,市场波动状况对企业和农户利益联结方式产生了显著的负向作用。最后,文章提出促进农户与企业建立紧密利益联结机制的对策建议。Abstract: Establishing farmers incubators is a significant measure to stimulate the development of modern agriculture and a useful way to increase farmers' income.Thus it's important to build a reasonable profit sharing pattern to balance the interests of stakeholder. Based on the investigation data of Fujian farmer incubators, we analyzed the influencing factors for farmers and enterprises choice on the modes of interest connection based on logistic regression analysis approach. The results showed that from the perspective of farmers, the educational background of farmers, annual per capita income of farmers, target markets, commercialization rate of agricultural products and the scale of agricultural products sold by agricultural enterprises had significant positive effects on farmers' decision-making, and the market fluctuation had significant negative effect. From the perspective of enterprises, the enterprise types, sales volume, target markets and agricultural products purchased from farmers had significant positive effects on enterprises' decision-making, and the market fluctuation had a significant negative effect.Finally, the paper puts forward some suggestions on how to establish close benefit connection mechanism between farmers and enterprises.
-
Keywords:
- farmers incubators /
- stakeholders /
- logical regression analysis /
- profit sharing
-
番茄斑萎病毒Tomato spotted wilt orthotospovirus(TSWV)是Perbunyaviridae科, Tospovirus属的代表种,主要由西花蓟马以持久增殖型方式进行传播。TSWV可以侵染85个科1090种植物,是目前寄主最广泛的植物病毒[1]。TSWV能够危害蔬菜、花卉及多种粮食作物,如番茄、辣椒、马铃薯、花生、莴苣、豌豆、烟草、菊花、银莲花、白日草、大岩桐、大丽花及仙客来等,对许多经济作物及庭院植物造成严重经济损失[2],已被列为全球十大植物病毒之一,危害性仅次于位列榜首的烟草花叶病毒Tobaco mosaic virus(TMV)[3]。1944年,在我国成都地区的番茄上首次发现该病毒,随后在四川、广东、云南、北京、天津、宁夏等地相继发现[4]。近年来,该病毒在中国部分地区的危害逐渐加重。基于对该病毒的危险评估,我国于2007年将TSWV列为进境植物检疫性有害生物[4]。
TSWV的基因组为三分体RNA,根据其分子量大小,分别命名为L RNA、M RNA和S RNA,3个片段5'端和3'端有8个互补并高度保守碱基,5'端为:5'-UCUCGUUA,3'端为3'-AGAGCAAU,形成假环状结构[5]。L RNA为负义链,而M RNA和S RNA是双义链[6]。L RNA的互补链中含有一个开放阅读框(ORF),用于编码RNA依赖性RNA聚合酶(RdRp)[7-8]。M RNA和S RNA均含有由富含A-U的基因间隔区分隔的两个ORF。M RNA中病毒链编码运动蛋白NSm[9-12],而互补链编码糖蛋白Gn和Gc[13-14]。S RNA中病毒链编码RNA沉默抑制子蛋白NSs[15-16],而互补链编码核衣壳蛋白N [17]。N蛋白有多个与RNA结合的位点,可以以多聚体的形式存在参与RNPs的组装[18-19]。N蛋白在寄主植物内可以与TSWV的糖蛋白Gn/Gc互作,可能与病毒粒子的装配相关[20]。在活体及离体实验中,N蛋白均可与TSWV的运动蛋白NSm发生互作[21]。
目前,国内外对番茄斑萎病毒病的防治开展了较多研究,多以控制传毒介体为主要防治手段。加强对TSWV的监测预报并且通过治虫防病是主要防控措施。所以,在田间对辣椒、番茄等作物进行病毒监测及检测尤为重要。目前,对TSWV进行检测的方法主要有RT-PCR、qPCR、in-ELISA、dot-ELISA和电镜观察等。其中,利用抗体进行血清学检测可以快速监测田间番茄、辣椒及西花蓟马的带毒率。而且血清学检测具备高效、快速、灵敏度高、成本低廉的特点。因此,本研究原核表达TSWV核衣壳蛋白N、糖蛋白Gn,并且免疫新西兰大白兔,制备了多克隆抗体,并通过Western blot及间接ELISA检测对抗体的特异性及效价进行了测定,为田间番茄斑萎病毒病的快速检测和预报提供技术支持。
1. 材料与方法
1.1 材料
感染TSWV的病株采自云南昆明,通过三生烟和鉴别寄主纯化病毒后,汁液摩擦接种保存在本氏烟上Nicotiana benthamiana,Escherichia coli DH5α以及Rosetta菌株置于-80℃保存。
Trizol、Gateway系统载体pDONR221和pDEST17、BP Clonase Enzyme Mix、LR Clonase Enzyme Mix购自Invitrogen公司;EasyTaq® DNA Polymerase、TransStart® TopTaq DNA Polymerase、Trans2K Plus DNA Marker购自TransGen Biotech公司;蛋白Marker购自Thermo公司;HiScript 1st Strand cDNA Synthesis Kit购自Vazyme公司;弗氏佐剂、不完全佐剂、IPTG、羊抗兔IgG、BCIP/NBT购自Sigma公司;硝酸纤维素膜购自Amersham Pharmacia公司。
PCR引物根据GenBank中TSWV N已知基因序列(GenBank No. JF960235.1), Gn已知基因序列(GenBank No. JF960236.1),设计相应引物,由生工生物工程(上海)股份有限公司合成,见表 1。
表 1 PCR引物Table 1. PCR primers引物名称 引物序列5'-3' 引物用途 N-F GGG GAC AAG TTT GTA CAA AAA AGC AGG CTT CAT GTC TAA GGT TAA GCT CAC N的扩增 N-R GGG GAC CAC TTT GTA CAA GAA AGC TGG GTC TTA AGC AAG TTC TGC AAG TTT TG N gene cloning Gn-F GGG GAC AAG TTT GTA CAA AAA AGC AGG CTT CAT GGA TCA TCC TGA GGT TTA TG Gn的扩增 Gn-R GGG GAC CAC TTT GTA CAA GAA AGC TGG GTC ACC AGG TTT TTT TAT CAA ATA AC Gn gene cloning 1.2 方法
1.2.1 TSWV N和Gn基因原核表达载体的构建
从感病的辣椒叶片中提取RNA,应用HiScript 1st Strand cDNASynthesis Kit反转录试剂盒合成cDNA,以cDNA为模板进行PCR扩增反应,获得目的基因N和Gn。按Invitrogen公司BP Clonase Enzyme Mix说明书,分别将纯化回收后的N和Gn基因产物与pDONR221入门载体进行BP重组反应,PCR鉴定获得阳性克隆。菌落PCR的反应体系为:95℃预变性5 min;30个循环:95℃ 30 s、55℃ 30 s、72℃ 1 min;72℃继续延伸10 min;16℃保存。提取入门质粒pDONR221-N和pDONR221-Gn,并按Invitrogen公司LR Clonase Enzyme Mix说明书,分别将质粒和目的载体pDEST17进行LR重组,菌落PCR鉴定阳性克隆并提取质粒。阳性克隆菌液送生工生物工程(上海)股份有限公司测序,验证其基因序列的正确性。
1.2.2 TSWV N和Gn蛋白的原核表达
将质粒pDEST17-N和pDEST17-Gn转化到大肠杆菌表达菌株Rosetta细胞内,菌落PCR筛选阳性克隆,菌落PCR的反应条件同1.2.1。将阳性克隆菌液按照1: 100的比例接种到10 mL的LB培养基中,28℃培养菌液使菌液OD600的数值在0.6~0.8,再加入终浓度1 mmol·L-1的IPTG,在28℃ 220 r·min-1的条件下对菌体进行5 h的蛋白表达诱导。离心,收集菌体,加入1×SDS上样缓冲液,沸水加热变性10 min离心,取10 μL上清进行聚丙烯酰胺凝胶电泳分析。电泳结束后考马斯亮蓝染色、凝胶脱色、观察蛋白表达情况并比对大小。
1.2.3 TSWV N和Gn蛋白抗血清制备
28℃条件下,220 r·min-1诱导100 mL菌液5 h,8 000 g离心收集诱导菌液,加入10 mL 0.01 mol·L-1 PBS重悬菌体,加入5×SDS上样缓冲液,沸水中煮10 min,进行SDS-PAGE凝胶电泳。电泳结束后,将凝胶浸泡在预冷的KCl(0.1 mol·L-1)溶液中进行染色,并将目的蛋白条带切割用于免疫新西兰白兔。首次免疫时,将目的蛋白胶条放于研钵内,加入适量的生理盐水以及弗氏完全佐剂充分研磨,将混匀乳化后的蛋白多点注射入新西兰大白兔的皮下肌肉。之后的加强免疫过程中,加入生理盐水和弗氏不完全佐剂进行研磨,免疫新西兰大白兔的皮下肌肉。每隔7 d免疫1次,共免疫5次,动脉取血后置于37℃静止1 h,4℃过夜,离心收集血清即为制备的抗血清。制备好的抗血清加入质量浓度为0.2 mg·mL-1叠氮化钠,置于-80℃长期保存。
1.2.4 Western blot检测多克隆抗体的特异性
参照John等[22]的方法提取携带TSWV的辣椒及健康辣椒的总蛋白,进行SDS-PAGE电泳。将NC膜放在转移缓冲液中浸泡20 min;湿式转移法恒压15 V,60 min进行转膜。将NC膜放入封闭液中37℃孵育1 h。TTBS洗膜3次,每次间隔5~10 min;将NC膜放入抗血清溶液(1: 2 000)中,37℃下孵育1 h。TTBS洗膜3次,每次间隔5~10 min。将NC膜放入碱性磷酸酶标记的羊抗兔IgG溶液(1: 10 000)中,37℃下孵育1 h。TTBS洗膜3次,每次间隔5~10 min;最后将NC膜浸没在20 mL的底物显色稀释液中2 min,然后加入40 μL NBT/BCIP的显色液,混合均匀,避光静止至NC膜显色,再将NC膜放入去离子水中终止反应。
1.2.5 间接ELISA检测抗体效价
利用间接ELISA进行抗体效价的测定。称量新鲜的感染TSWV及健康的辣椒叶片各1 g于研钵中,加入1 mL碳酸包被液充分研磨后,12 000 r·min-1离心2 min。在酶联板上,每孔加入100 μL的样品溶液。密封酶联板,将其置于37℃恒温培养箱中进行1 h的封闭孵育。快速垂直倾倒抗原溶液,使用PBST缓冲液洗涤酶联板5次,每次5 min。依次加入梯度稀释(1: 100、1: 200、1: 400、1: 800、1: 1 600、1: 3 200、1: 6 400、1: 12 800)的N和Gn多克隆抗体,每个稀释梯度3个重复,密封酶联板置于37℃恒温培养箱中进行1 h孵育。PBST洗涤5次,每次5 min。向每孔加入100 μL稀释10 000倍的羊抗兔IgGs,密封后置于37℃恒温培养箱中进行2 h孵育。PBST洗涤5次,每次5 min。最后每孔加入100 μL底物,避光置于37℃的恒温箱中,约5~10 min出现显色,立即用酶标仪在波长405 nm下读取数据。根据阳性对照:阴性对照>2倍以上的抗体最大稀释倍数为抗体的效价。
1.2.6 Dot-ELISA检测TSWV
分别取感病和健康的辣椒叶片0.2 g,并加入1 mL PBS于研钵中进行研磨,12 000 r·min-1离心5 min后,取2 μL上清液加入对应的NC膜上,37℃孵育30 min;将NC膜浸入含50 mg·mL-1脱脂奶粉中,37℃封闭30 min;分别放入N、Gn的抗体(1: 3 000)中,37℃孵育30 min;PBST洗涤3次,每次5 min;取出NC膜,放入AP酶标的羊抗兔IgGs(1: 10 000),37℃孵育30 min;PBST洗涤5次,每次5 min;滤纸吸干NC膜上的液体后再将其置于滴加适量NBT/BCIP的底物显色稀释液中,待样品显色,而阴性无显色现象时,停止反应,记录试验结果。
2. 结果与分析
2.1 TSWV-N和Gn基因的克隆及其原核表达载体的构建
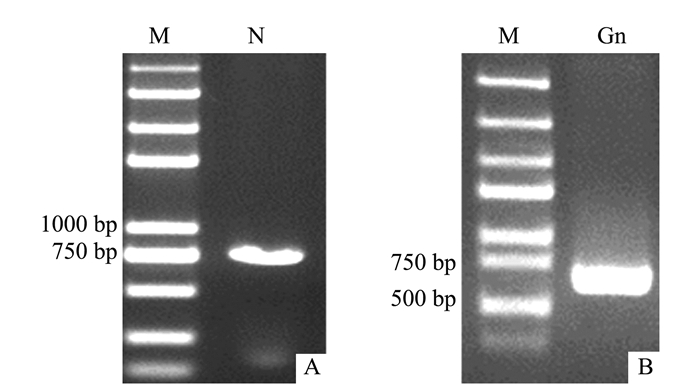
从感病的辣椒叶片中提取总RNA,利用TSWV的N基因的特异性引物N-F、N-R及TSWV Gn基因的特异性引物Gn-F、Gn-R进行RT-PCR分别获得777 bp和639 bp大小片段(图 1),Gateway重组获得原核表达载体pDEST17-N和pDEST17-Gn,菌液PCR验证同样获得777 bp和639 bp大小片段(图片未提供)。经测序,验证了N和Gn原核表达载体的正确性。
2.2 TSWV-N和TSWV-Gn蛋白的诱导表达
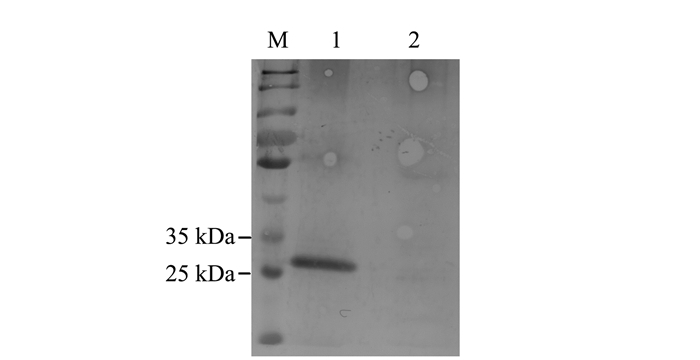
重组质粒pDEST17-N和pDEST17-Gn分别转入原核表达菌株Rosetta后,筛选阳性克隆,使用终浓度为1 mmol·L-1IPTG进行诱导,SDS-PAGE检测发现,与未诱导的菌液相比,含pDEST17-N、pDEST17-Gn的菌液分别在28 kDa和25 kDa附近有明显的目的蛋白条带(图 2),与预期的蛋白大小一致,说明目的蛋白被诱导表达。
2.3 Western blot检测多克隆抗体的特异性
为检测抗体的特异性,分别以感染TSWV和健康的辣椒总蛋白为样品,抗N和Gn蛋白多克隆抗体为一抗,羊抗兔IgG为二抗,进行Western blot分析。结果显示N抗体能特异性识别感病植株中28 kDa蛋白,而健康辣椒样品没有检测到该蛋白条带(图 3),说明获得的抗N蛋白的多克隆抗体具有很好的特异性。而Gn抗体没有检测到明显的条带(数据未列出),可能原因为感病植株Gn的表达量低,Western blot试验中,Gn抗体不能敏感地识别到抗原。
2.4 间接ELISA检测抗体的效价
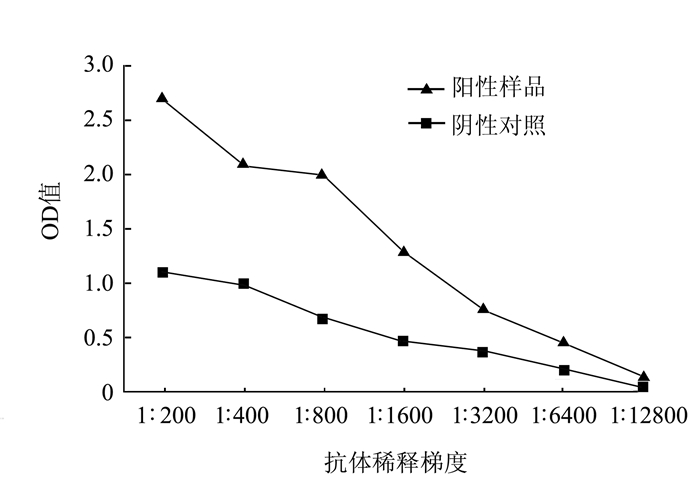
分别以感病和健康辣椒作为抗原,N和Gn免疫抗体作为一抗,利用in-ELISA的方法对抗体效价进行检测,试验重复3次。数据显示,质量浓度为1 mg·mL-1的带毒辣椒汁液可以与稀释12 800倍的N抗体产生阳性免疫反应,表明N抗体效价为1: 12 800(图 4)。而Gn抗体在稀释200倍的情况下仍不能与抗原反应显色,无法检测出Gn的效价。
2.5 Dot-ELISA检测TSWV
分别以感病和健康辣椒为抗原,N和Gn免疫抗体作为一抗进行Dot-ELISA检测。结果表明,仅以N抗体为抗的试验中,感病辣椒出现阳性的免疫斑点,而健康辣椒呈现阴性反应(图 5),而Gn抗体试验中阳性样品无免疫斑点。则外壳蛋白N抗体能很好地用于检测TSWV。
3. 讨论与结论
近年来,番茄斑萎病毒病害在我国云南地区的多种蔬菜和花卉作物上连年发生,造成了巨大的减产和经济损失。因该病毒病害的寄主范围广,危害性大,已被列为世界危害最大的植物病毒病害之一[23]。本研究克隆了TSWV的N和Gn基因,通过Gateway技术将基因构建到原核表达载体pDEST17上,再将其转入Rosetta细胞内,IPTG诱导表达蛋白,并免疫新西兰大白兔获得多克隆抗体。与纯化植物病毒粒子为抗原制备抗体的传统方法相比,利用大肠杆菌原核表达病毒蛋白作为抗原制备抗体,抗原易获取、纯度高,抗体特异性高,不易出现血清学的交叉反应。经Western blot检测抗N蛋白的多克隆抗体具有很好的特异性,并且抗体效价较高,既可用于TSWV在田间的诊断,又可为开展病毒在介体昆虫细胞的定位、病毒和介体的互作研究提供实验材料。而膜多糖蛋白Gn多克隆抗体在Western blot及间接ELISA试验中均未检测出明显的特异性和效价。TSWV N和Gn蛋白为结构蛋白[13-14, 17],理论上两个蛋白都能够作为病毒检测的理想靶标。但本研究仅证明了N蛋白的多克隆抗体可用,Gn蛋白的表达量远低于N蛋白的表达量。本研究同时制备了TSWV NSs和NSm非结构蛋白的多克隆抗体,但在病株诊断灵敏度检测水平远低于N蛋白抗体的检测水平。因此田间诊断TSWV的发生情况,可优先选用N蛋白的多克隆抗体,并可将其加工成试纸条进行田间病毒样品的快速检测。本研究利用制备的多克隆抗体建立了dot-ELISA检测TSWV的技术。此方法只需极少量的样品且操作简单快捷,格外适合于数量稀少的样品检测。
于翠等[24]通过原核表达载体pET-32a,表达纯化了TSWV N蛋白,并制备了单克隆抗体,可用于田间病毒样品的检测。但单抗制备过程周期长,成本高,需要获得多株细胞株验证抗体的实用性。同时制备的多克隆抗体能识别多个抗原表位,制备周期短,成本低,可更好地应用于田间病株的检测,对TSWV病毒病害的检测、预测预报和防控具有重要意义。
-
表 1 农户决策的变量解释说明
Table 1 Variation explanation on Farmers' choice
变量 变量名称 变量解释说明 Y1 农户与企业的利益联结方式 反映联结方式从松散到紧密的程度 X1 文化程度 代表农民的学历程度,包括小学到大专以上 X2 农户全年人均收入 代表农民的个人收入水平 X3 市场波动状况 反映市场价格的波动性 X4 目标市场 衡量农产品是面向本地市场、国内还是国外市场 X5 农产品商品率 反映农民生产农产品参与市场化程度 X6 企业销售农产品规模 反映农产品通过企业销售的份额占总销售额的比例 表 2 企业决策的变量解释说明
Table 2 Variation explanation on Companies' choice
变量 变量名称 变量解释说明 Y2 企业与农户利益联结方式 反映联结方式从松散到紧密的程度 Z1 企业类型 一定程度上反映企业的综合能力 Z2 企业全年销售额 反映企业销售能力 Z3 目标市场 衡量农产品是面向本地、国内还是国外市场 Z4 市场波动状况 反映所售产品市场价格的波动程度 Z5 收购农户产品占比 反映企业收购当地农户产品的比重 表 3 农户决策的逻辑回归模型结果分析
Table 3 Results of Logistic Regression Analysis on Farmers′ choice
变量 回归系数 标准误 Wald统计量 自由度 P值 OR X1 0.794 0.276 8.292 1 0.004 2.212 X2 0.514 0.258 3.948 1 0.047 1.671 X3 -0.429 0.18 5.685 1 0.017 0.651 X4 0.699 0.218 10.235 1 0.001 2.011 X5 1.034 0.441 5.49 1 0.019 2.812 X6 0.497 0.169 8.679 1 0.003 1.644 表 4 企业决策的逻辑回归模型结果分析
Table 4 Results of Logistic Regression Analysis on Companies′ choice
变量 回归系数 标准误 Wald统计量 P值 OR Z1 0.289 0.092 4.990 0 3.331 Z2 0.646 0.160 2.953 0.002 1.157 Z3 0.396 0.623 2.635 0.002 1.688 Z4 -2.219 0.668 3.324 0.001 3.173 Z5 0.484 0.224 4.142 0 2.746 -
[1] 满海红, 张强.农业产业化中的利益联结机制构建[J].商业时代, 2008(12):106-107. DOI: 10.3969/j.issn.1002-5863.2008.12.058 [2] 肖静, 刘小芬.企农利益联结模式研究[J].农业经济, 2013(6):127-128. DOI: 10.3969/j.issn.1001-6139.2013.06.055 [3] 杨孝伟, 尚士涛, 胡晓娅.新型农业经营主体构建中龙头企业与农民合作社利益联结模式研究[J].商业经济研究, 2015(14):121-122. DOI: 10.3969/j.issn.1002-5863.2015.14.046 [4] 陈别锐, 刘晓辉, 谭增夫.现代农业园区培养新型职业农民的实践与启示[J].西北农林科技大学学报(社会科学版), 2014, 14(3):58-61. http://d.old.wanfangdata.com.cn/Periodical/xbnlkjdxxb-sh201403009 [5] 张家园, 林乃宏, 梁鹂, 等.四川宜宾:创新农民增收利益联结机制[J].中国财政, 2014(18):65-66. http://d.old.wanfangdata.com.cn/Periodical/zgsp201721018 [6] 华静, 王玉斌.我国农业产业化发展状况实证研究[J].经济问题探索, 2015(4):70-74. DOI: 10.3969/j.issn.1006-2912.2015.04.012 [7] 白丽, 赵邦宏.产业化扶贫模式选择与利益联结机制研究:以河北省易县食用菌产业发展为例[J].河北学刊, 2015, 35(4):158-162. http://www.cnki.com.cn/Article/CJFDTOTAL-HEAR201504030.htm [8] 朱满德, 江东坡, 邹文涛.贵州省龙头企业与农户利益联结机制探究[J].江苏农业科学, 2013, 41(9):413-415. DOI: 10.3969/j.issn.1002-1302.2013.09.153 [9] 王锋.以合理的利益联结机制促进农民增收[J].农业经济, 2006(10):36-37. DOI: 10.3969/j.issn.1001-6139.2006.10.014 [10] 蔡雪雄, 张若男.福建省台湾农民创业园发展模式研究[J].亚太经济, 2012(6):142-145. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=QK201205783913 [11] 宋建晓, 贺亚萍, 黄森慰.基于SWOT-PEST模型的福建台湾农民创业园发展战略分析[J].福建论坛(人文社会科学版), 2015(4):148-153. http://www.cnki.com.cn/Article/CJFDTOTAL-FJLW201504028.htm [12] 宋印伟.新时期福建台湾农民创业园发展存在的问题及对策研究[D].福州: 福建农林大学, 2015. -
期刊类型引用(5)
1. 王鑫,郑立敏,赵星月,苗淑月,叶倩,张宇,史晓斌,张德咏,陈建斌. 西花蓟马FKBP6蛋白多克隆抗体制备、真核表达及亚细胞定位. 农业生物技术学报. 2024(07): 1606-1613 .  百度学术
百度学术
2. 刘欢,何斐,李川. 魔芋病毒病研究进展. 山西农业科学. 2023(02): 217-224 .  百度学术
百度学术
3. 邱佳,余瑛. 东亚飞蝗DSCAM2多克隆抗体制备. 重庆理工大学学报(自然科学). 2023(02): 350-356 .  百度学术
百度学术
4. 米国全,唐艳领,牛莉莉,马凯,杨凡,史宣杰,赵秀山,王晋华. 危害我国番茄的重要病毒病及防控措施. 中国瓜菜. 2021(10): 8-14 .  百度学术
百度学术
5. 林丹,林文忠,尚鹏祥,林文武,丁新伦,吴祖建,张洁. 木尔坦棉花曲叶病毒编码4个蛋白的抗血清制备. 福建农业学报. 2021(11): 1359-1364 .  本站查看
本站查看
其他类型引用(2)
计量
- 文章访问数: 1171
- HTML全文浏览量: 177
- PDF下载量: 12
- 被引次数: 7




 下载:
下载: