Construction and Genetic Background Recovery of Blast-resistant Near-isogenic Lines from Japonica Variety, Yunyin
-
摘要: 通过对稻瘟病抗性近等基因系的构建和评价,为抗稻瘟病基因的抗性分析和遗传学研究提供良好载体。分别以广谱抗稻瘟病品种云引和普感稻瘟病品种丽江新团黑谷(LTH)为抗病基因的供体亲本和轮回亲本,结合分子标记辅助选择和人工接种抗性鉴定,经连续4代回交和8代自交,获得7个以LTH为遗传背景的稻瘟病抗性近等基因系。选取均匀分布于水稻12条染色体上的184对SSR标记,对所获得的近等基因系进行遗传背景分析、评价。结果表明:在亲本云引和LTH之间具多态性的SSR引物有72对,标记多态性频率为39.1%。以在亲本间具有多态性的标记对7个近等基因系与LTH间的遗传多态性进行分析,发现其中W15、W17的遗传背景恢复率为97.61%,W18的遗传背景恢复率为97.22%,其他4个株系的遗传背景恢复率均大于98%。成功构建并获得了以LTH为背景的含有云引稻瘟病抗性基因的近等基因系,且近等位基因系的遗传背景与表型值均恢复良好。Abstract: Construction of near-isogenic lines(NILs) is an effective mean for analyzing blast-resistance genes as well as genetic research in general. This study applied the broad-spectrum blast-resistant japonica variety, Yunyin, as the donor parent and the blast-susceptible variety, LTH, as the recurrent parent. Combining the molecular markers assisted selection and artificial inoculation, 7 blast-resistant NILs were bred with LTH for the genetic background analysis after 4 generations of backcrossing and 8 generations of self-crossing.184 pairs of SSR markers evenly distributed on 12 chromosomes of the rice were selected to evaluate the genetic background of the NILs. The results showed that 72 pairs of SSR primers to be polymorphic with a frequency of 39.1%. The polymorphisms between 7 NILs and LTH were analyzed by markers among the parents. The background recovery rates of W15 and W17 were 97.61%, that of W18, 97.22%, and those of other 4 lines, greater than 98%. It appeared that the construction of NILs carrying Yunyin blast-resistance gene with LTH as background were successful, and that all phenotypic indices of the NILs recovered well in this study.
-
Keywords:
- rice /
- rice blast-resistance /
- near-isogenic lines /
- genetic background
-
水稻Oryza sativa是重要的粮食作物,其产量与人们的日常生活和生产实践息息相关。然而,许多高产水稻良种在其正常生长发育后期常发生早衰现象,严重制约了水稻产量的形成。所谓水稻早衰就是指水稻植株在发育到抽穗至成熟期期间,叶片过早衰老,出现黄化、蔫化以及褐色或棕红色生理病斑。具体表现为叶尖呈污白干枯状,叶面积减小,植株茎干变脆;根系吸收能力弱化甚至出现黑根和坏死根系等异常性状。在生理水平上,其特征还包括光合系统解构,叶绿素、脂质、RNA和可溶性蛋白等大分子物质降解及光合产物、糖类、碳水化合物等积累量的迅速减少[1-7]。植物体内的抗氧化保护酶代谢是自身衰老过程中最主要的保护体系[8]。Hua等[9]在对三系杂交水稻叶片衰老的研究中发现,水稻叶片整个衰老过程均伴随着SOD酶和CAT酶活性的逐渐下降以及丙二酸(MDA)的不断积累;其中SOD酶和CAT酶活性变化的差异可能是导致Oi中间体形成并损害细胞膜的原因。Li等[10]则通过利用水稻叶片早衰突变体及其野生型探究了灌浆期抗氧化酶类活性时空动态变化,发现灌浆期水稻早衰突变体叶片抗氧化酶对ROS清除能力明显低于野生型; 而过氧化氢酶基因家族成员表达下降引起的过氧化氢含量显著增加可能与水稻叶片衰老的起始相关。一般来说,植物体内自由基的形成与清除过程常常处于动态平衡当中。但当这种平衡打破时,多余自由基就会损伤细胞并促使其衰老,最终引起早衰现象的发生[11-12]。同时,细胞代谢过程中的各种激素失调、环境生物与非生物因子的胁迫等都是植物早衰形成的重要因素[13-16]。除此之外,最新的研究结果表明水稻根际微生物组变化与作物生育期过程息息相关[17]。部分研究学者认为,植物根际能够塑造特定的土壤微生物群落结构;根际土壤微生物的宏基因组作为植物自身基因组以外的“第二基因组”可以直接反映植物自身的健康状况[18]。East等[19]甚至提出,应将整个植物体看成是由植物本身、根际及其周围微生物所组成的结合体,即根际微生态系统。类似地,Kundu等[20]在对人类肠道微生物的研究中发现,肠道微生物群落组成能够随人类年龄的变化而体现老年人与婴儿时期的截然不同。Claesson等[21]的研究结果认为老年人肠道微生物群落与居住环境及饮食密切相关;补充双歧杆菌等益生菌有助于保持健康和延缓衰老。说明,根际土壤微生物组变化不仅可以反映作物根系衰老的情况还可能与根系衰老的调控过程相关,有待进一步更深入的研究。
液泡膜ATP酶(V-ATPase)是一种广泛存在于真核生物液泡膜上的由多亚基基因共同编码的酶类,主要功能包括偶联ATP水解的质子主动转运以及控制其他溶质进出液泡和细胞质。因而在维持细胞稳态方面发挥重要作用[22-23]。OsVHA-A1基因负责编码的A亚基是液泡膜ATP酶的主要催化中心并参与ATP的绑定。Shou等[24-25]通过研究发现Sumit A亚基中的非同源区域(non-homologous region)突变会大大降低ATP水解能力和质子解偶联;这段区域的改变甚至还参与调节液泡膜ATP酶其他亚基的解离而影响V-ATPase整体功能水平。张慧荧[22]利用水稻OsVHA-A基因的RNAi敲除株系研究发现,突变体中OsVHA-A基因表达量相对野生型明显下调。同时,突变体植株的V-ATPase活性也显著降低。Yang等[26]的研究结果表明,OsVHA-A1基因缺失突变会导致较高水平的ROS积累和协调水杨酸信号途径调控下游WRKY家族基因表达。因而,从分子角度很好地解释了由水稻OsVHA-A1基因缺失突变引起的水稻叶片早衰的分子机制。但关于OsVHA-A1基因缺失突变体叶片与根系生育期生理生化过程变化以及地下部根系衰老与地上部叶片衰老间的关系尚不清楚。因此,本研究采用已经筛选鉴定的纯合水稻OsVHA-A1基因缺失突变体株系及其野生型为材料,初步探究了由OsVHA-A1基因缺失介导的水稻早衰生理学过程与机理,为解释基因遗传的水稻早衰现象以及探寻常规水稻高产提供理论依据。
1. 材料与方法
1.1 试验材料
供试的水稻材料为浙辐142 (Oryza sativa L. ssp. indica, 编号Y211)与突变体水稻株系(编号Y225)。该突变体是通过对浙辐142种子进行T6aCoY射线辐照处理后,经连续8代的自交纯合及表型筛选获得,表现为早衰遗传性状。本研究供试突变体水稻材料是第9代种子。另外,Yang等[26]采用Y225株系的M8代种子,利用图位克隆的方法验证该基因突变为编码水稻液泡膜ATP酶基因OSPLS1/OSVHA-A基因的胞嘧啶缺失突变,并定位在6号染色体上S3与S5区域的一段约85 kb大小的片段。
1.2 试验方法
1.2.1 田间与盆栽水稻材料种植
田间试验于2017年在福建农林大学作物标本园进行,室内试验在福建农林大学作物遗传育种与综合利用教育部重点实验室开展。将催芽露白的种子于当年4月25日播撒在沙土盆中育苗,在5月20日进行田间移栽。田间种植区分布采用随机区组设计,突变体与野生型株系各种植3个重复小区,每个小区包括10行,每行12株。采用常规肥水管理,并于突变体水稻及其野生型处于不同生育期时取叶片和根系样品进行农艺性状统计和生理指标的测定。尽可能选取长势一致的植株,同时保证样品完整。
1.2.2 OsVHA-A1基因缺失突变体与其野生型不同生育期生理生化过程变化
(1) 抗氧化酶活性测定:分别取0.5 g突变体与野生型水稻叶片及根系样品于PBS buffer中(pH=7, CAT和pH=7.8, SOD、POD、CAT)冰浴研磨至匀浆。之后再4℃, 14 000 g条件下离心20 min,上清液即为粗酶液。抗氧化酶活性测定参考文献[27-32]。
(2) 过氧化氢(H2O2)含量测定:按照Chakrabarty等[33]的方法测定H2O2含量。先称取1 g水稻根系样品,加入0.5 mL的0.1%三氯乙酸溶液(TCA)后冰浴研磨至匀浆状,19 000 g离心20 min。离心后取上清液0.5 mL,加入2 mL 1 mol·L-1碘化钾溶液(KI)和0.5 mL 100 mmol·L-1硫酸钾溶液(K2SO4),暗反应1 h。反应结束后,以0.1%的TCA为参比,测定在390 nm处的吸光值。标准曲线绘制:分别取质量浓度为10.00 mg·L-1的H2O2标准液0.00、1.00、2.00、3.00、4.00、5.00 mL于100 mL容量瓶中,加入2 mL 2%酒石酸溶液,2 mL 1 mol·L-1硫酸溶液,2 mL 2.5%碘化钾溶液,用蒸馏水定容混匀后,以蒸馏水为参比在352 nm下测定吸光度值(OD),绘制标准曲线,并计算样品中过氧化氢的含量。
(3) O2-产生率测定:参考Kumar G等[34]的方法,先称取0.2 g根系样品洗净后置于预冷的研钵中,加入共1.6 mL 50 mmol·L-1预冷的磷酸缓冲液(pH7.8)在冰浴上研磨成匀浆,之后转移至新的离心管,在4℃、12 000 g条件下离心20 min。再取0.5 mL上清液加入0.5 mL PBS(0.05 mol·L-1,pH7.8),1 mL 10 mmol·L-1盐酸羟胺溶液,摇匀后在25℃下保温1 h,依次加入1 mL 17 mmol·L-1对氨基苯磺酸,再加入1 mL 7 mmol·L-1α-萘胺,混合后涡旋,在25℃下保温20 min后在3 000 g离心3 min;以PBS对照管调零,测定OD530nm。
(4) MDA含量测定:参考Ke E等[35]的方法,称取0.5 g样品剪碎并放入研钵中,加入5 mL 5%TCA溶液研磨至匀浆后转入离心管中,在3 000 r ·min-1下离心20 min;取上清液2 mL于新的离心管内,加入等体积的0.67%TBA(硫代巴比妥酸)混匀后在100℃沸水浴中煮30 min,用冷水迅速冷却,再在3 000 r·min-1下离心10 min;取上清液在450 nm、以去离子水调零,在532 nm、600 nm波长下测OD。MDA浓度C (μmol·L-1) =6.45(OD532-OD600)-0.56OD450 MDA含量(μmol·g-1 FW)=C×V/W。
1.2.3 基因表达与酶活性测定
(1) 液泡膜ATP酶活性:液泡膜ATP酶活性测定采用植物氢ATP酶定量检测试剂盒(HePeng,Biotech.)。称取长势一致的突变体与野生型新鲜根系样品1 g,放入预冷的15 mL离心管,加入3 mL清洗液清洗,立即用剪刀剪碎组织。之后加入1 mL裂解液,充分涡旋。混合液转移至新的1.5 mL离心管,在4℃条件下,5 000 g离心5 min,上清液移至新的1.5 mL离心管。移取10 μL进行蛋白质定量检测,检测方法参考Bradford法[36],稀释至总蛋白为100 μg后放进-80℃冰箱保存。将样品从冰箱取出依次加入730 μL缓冲液、20 μL酶促液、100 μL反应液、100 μL底物液于28℃培养箱中静置3 min。加入50 μL待测液样品,对照为50 μL阴性液,上下颠倒后立即在340 nm波长下测定OD值。酶活性计算公式为:(样品读数-背景读数)×体系容量×稀释倍数/0.05(样品容量)× 6.22(毫摩尔吸光系数)× 30(反应时间)
(2) 突变体与野生型水稻叶片和根系中OsVHA-A1基因表达分析:水稻组织RNA提取采用Tranzol法。具体步骤如下:选取新鲜的植物组织样品约100 mg左右,在液氮下迅速研磨成粉末后倒入装有预冷的1 mL Tranzol试剂的离心管中,震荡混匀,室温下静置3~5 min。此后,加入200 μL氯仿溶液并剧烈震荡,室温下放置5 min后,于4℃,12 000 g条件下离心15 min。取离心好的上清液转移至新的离心管,加入500 μL异丙醇,轻轻混匀,低温下(-20℃)放置30~60 min以使得RNA沉淀。在4℃条件下12 000 g离心10 min后,小心倒掉上清液。加入1 mL 75%的DEPC-乙醇,温和振荡离心管并清洗RNA沉淀;再在4℃下7 500 g离心5 min,之后倒掉上清液。将沉淀放置在超净台中晾干,溶解于70 μL RNA溶解液中。利用紫外分光光度计测定RNA样品的含量与纯度, 提取的总RNA样品通过1.2%琼脂糖凝胶电泳检测质量。
基因组总DNA去除与cDNA第一链合成采用TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒。将提取好的总RNA依次加入10 μL 2×TS Reaction Mix, 1 μL Random Primer(N9) (0.1 μg·μL-1), 1 μL Trans Script® RT/RI Enzyme Mix, 1 μL gDNA Remover并加入RNase-free Water至总体积20 μL。25℃孵育10 min后,在42℃保温15 min以合成cDNA第一链,随后在98℃保持3 min以终止反应。冷却后,得到的cDNA即可用于RT-PCR以及荧光定量(QRT-PCR)分析。
荧光定量分析使用SYBR Green Real-time PGR Master Mix(TOYOBO, OSAKA, JAPAN)试剂盒。1 μL cDNA模板依次加入上、下游引物(10 μmol·L-1)各0.5 μL, 10 μL SYBR反应液, 添加无菌水至20 μL总体积。每个样品进行3次重复PCR,扩增条件:95℃ 5 min,95℃变性15 s,58℃退火30 s,72℃延伸40 s(用于荧光信号检测),39个循环,反应结束后从58~95℃构建熔解曲线,检测扩增反应的特异性。利用Bio-RadCFX96荧光定量RT-PCR仪(Bio-Rad,USA)完成扩增反应。采用2-△△Ct进行基因表达分析土壤酚酸类物质定量与根际微生物群落结构[37]。
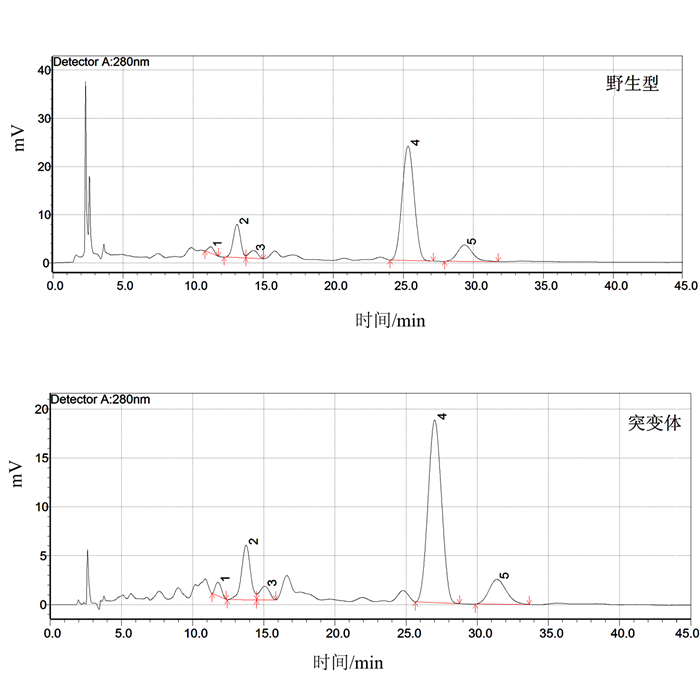
1.2.4 土壤酚酸测定(HPLC法)
根际土壤酚酸类物质测定参考吴丹等[38]的方法。将生长至灌浆高峰期时的突变体与野生型水稻从田中直接拔起,去除根际外周土壤(只保留紧贴根系的少量土体),置于含少量灭菌水的500 mL烧杯中,超声20 min。待根系变白后取出,刮取所得土于50 mL离心管中,4℃, 12 000 g离心15 min,即得所需根际土壤样品。标准品为没食子酸、对香豆酸、邻苯二甲酸、对羟基苯甲酸、香草酸、丁香酸、香兰素、阿魏酸、苯甲酸,分别配制成12.500 00、6.250 00、3.125 00、1.562 50、0.781 25 g·L-1梯度溶液。以峰面积为纵坐标,标准品浓度为横坐标构建峰面积-浓度标准曲线。HPLC条件为色谱柱: SinoChrom ODS-BP(4.6 mm × 280 mm,5 μm);检测波长: 280 nm;流速0.8 mL ·min-1; 柱温: 30℃; 进样量: 10 μL。流动相A为2%醋酸溶液,流动相B为甲醇,0~17 min (A: 75%~75%,B: 25%~25%), 17~45 min (A: 60%~75%,B: 25%~40%)。
1.2.5 水稻根际微生物群落多样性分析
(1) 土壤微生物总DNA提取:土壤微生物总DNA采用BioFast Soil Genomic DNA Extraction Kit试剂盒(MP Biomedicals),并用1.2%的琼脂糖凝胶进行初步检测。基因组DNA纯化采用胶回收纯化试剂盒(TianGen Biotech Co., Ltd),并利用紫外分光光度计检测DNA浓度和纯度(Nanodrop, America),将样品保存于-20℃冰箱。
(2) 细菌与真菌基因组的PCR扩增:根据文献目前已报道的细菌16S rRNA基因的V4高变区段序列设计引物,上游引物:515F (5′-GTG CCA GCM GCC GCG GTA A-3′)和下游引物:806R (5′-GGA CTA CHV GGG TWT CTA AT-3′);真菌PCR扩增引物分别为上游引物:515F (5′-GCA TCG ATG AAG AAC GCA GC-3′)和下游引物:806R (5′-TCC TCC GCT TAT TGA TAT GC-3′)。PCR反应体系总体积为25 μL,其中12.5 μL 2×Taq mix (SangonBiotech Co., Ltd.),1.0 μL上游引物, 1.0 μL下游引物, 1.0 μL DNA模板和9.5 μL ddH2O。反应扩增程序为94℃预变性5 min; 94℃变性1 min,55℃退火45 s,72℃延伸100 s,35个循环, 72℃延伸10 min, 4℃保存。PCR扩增产物经胶回收试剂盒(TianGen Biotech Co., Ltd.)回收后用1.2%琼脂糖凝胶进行电泳检测。产物经纯化后进行定量和均一化以形成测序文库,再对建设好的文库进行文库质量检验,最终将质检合格的文库交由北京诺禾致源公司并利用Illumina HiSeq PE250高通量测序仪完成测序。
(3) 生物信息学分析:筛选长度大于200 bp, 平均质量分值大于25及匹配度高于80%的序列(核糖体数据库http://pyro.cme.msu.edu/)。去除嵌合体后,利用QIIME将有效数据在97%水平上的分类为一个单元(Operational taxonomic unit,OTU),采用Greengene数据库进行物种注释[39]。最后使用Mothur软件对OTUs进行多样性分析和绘图[40-42]。
1.2.6 根系活力与叶绿素、光合作用相关性
(1) 叶绿素和光合速率:取新鲜的水稻叶片洗净并去除中脉,混匀后称取0.1 g样品3份于25 mL离心管,加入20 mL 95%乙醇,黑暗下过夜浸提。次日,待叶片样品变白后取出,用95%乙醇定容至25 mL,过滤后95%乙醇调零,分别在665 nm、649 nm和470 nm波长下测定吸光度。依据下列公式计算所提取叶绿素浓度。
Ca=13.95OD665−6.88OD649;Cb=24.96OD649−7.32OD665;Ct=Ca+Cb 光合速率釆用便携式光合测量仪(Li6400,America)。于孕穗、抽穗和灌浆高峰期测定旗叶光合速率和叶绿素荧光参数,每株选取5~7片叶,3次重复。
(2) 根系活力测定:根系活力测定采用TTC法,称取0.5 g根尖样品于10 mL烧杯中,加入0.4%TTC溶液和磷酸缓冲液的等量混合液10 mL(浸没根系),在37℃下暗保温2 h。此后加入2 mL的1 mol·L-1硫酸,以停止反应。之后把根取出,吸干水分与乙酸乙酯3 mL一起在研钵内磨碎,移入试管,并用少量乙酸乙酯洗涤3次,最后加乙酸乙酯使总量为10 mL,波长485 nm下比色,以空白试验(先加硫酸)作参比测出吸光度,参考标准曲线,求出四氮唑还原量,四氮唑还原强度/(mg·g-1根鲜重h-1)=四氮唑还原量(mg)根重(g)×时间(h)
1.3 数据分析
试验结果均采用Microsoft Excel 2003进行数据分析和作图,单因素方差分析(one-way ANOVA)和多重比较(Tukey法)采用DPS7.0软件。
2. 结果与分析
2.1 不同生育期两种基因型水稻形态特征及农艺性状比较
由图 1可见,OsVHA-A1基因缺失突变体在分蘖期与野生型长势相同,功能叶全部为绿色,早衰性状未表现或不明显。但直到孕穗期时,突变体下部叶开始逐渐变黄、变枯,功能叶片陆续黄化至抽穗期时出现典型锈状斑点和早衰表型。另外由表 1可见,田间种植至成熟收获后的OsVHA-A1基因缺失突变体水稻在株高、根长、叶干重及根干重等农艺性状指标上明显低于野生型;其产量相关的主要性状包括有效穗、结实率和千粒重差异均达到极显著。表明OsVHA-A1基因缺失突变会引起水稻植株严重的早衰与减产。
表 1 OsVHA-A1基因缺失突变体与其野生型水稻农艺性状Table 1. Agronomic traits of OsVHA-A1 mutant and wild type rice水稻
类型株高
/cm根长
/cm地上部
/cm根干重
/g叶干重
/g有效穗
/穗结实率
/%千粒重
/g野生 127.3±2.5A 18.9±1.4a 108.5±2.1A 1.34±0.1A 4.75±1.5A 11.2±2.1A 88.3±4.6A 25.3±1.5A 突变 86.8±3B 15.8±1.2b 67.5±2.5B 0.73±0.1B 1.26±1.2B 5.8±1.5B 37.6±5.6B 13.5±1.4B 注:同列数据后不同大、小写字母分别表示差异达极显著(P<0.01)和显著水平(P<0.05)。 2.2 两种基因型水稻根系与叶片抗氧化酶活性与ROS动态变化
由图 2可见,突变体与野生型叶片和根系的抗氧化酶活性(包括SOD、POD、CAT)随水稻自身生育周期呈现动态变化。返青与分蘖时期的抗氧化酶活性处于较低水平,孕穗期达到峰值后开始逐渐下降;突变体在孕穗期后的抗氧化保护酶活性低于野生型。同时,突变体叶片的O2-产生率、H2O2含量和MDA积累量在返青期和分蘖期时与野生型区别不大,但到了孕穗期时显著增加,灌浆高峰期差异最明显。根系的衰老情况与叶片相类似,不同的是突变体根系H2O2含量和O2-产生率在分蘖期时就已经显著高于野生型且孕穗期后的ROS含量与膜脂过氧化水平(MDA积累)显著高于同时期叶片。表明OsVHA-A1基因缺失引起突变体水稻植株抗氧化代谢显著下降,且突变体根系清除活性氧物质的能力低于其叶片。
2.3 苗期与灌浆高峰期OsVHA-A1基因表达与V-ATPase酶活性
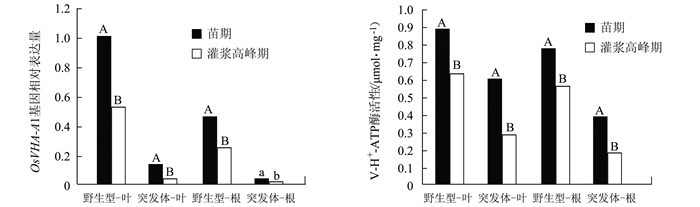
由图 3可见,无论是野生型还是突变体,叶片和根系在苗期的OsVHA-A1基因表达量均高于灌浆高峰期。野生型与突变体叶片中的OsVHA-A1基因在灌浆高峰期相对于苗期的下调表达量分别为47.81%和72.83%;而在根系的下调表达量分别为45.59%和60.58%。V-ATPase活性测定的结果显示相同的趋势。野生型与突变体叶片中的V-ATPase活性在灌浆高峰期比苗期下降29.67%和51.64%;而在根系分别为27.34%和50.45%。表明OsVHA-A1基因表达与V-ATPase酶活性存在时序性和组织间表达差异性,OsVHA-A1基因缺失突变会对OsVHA-A1基因表达与V-ATPase酶活性造成显著影响。
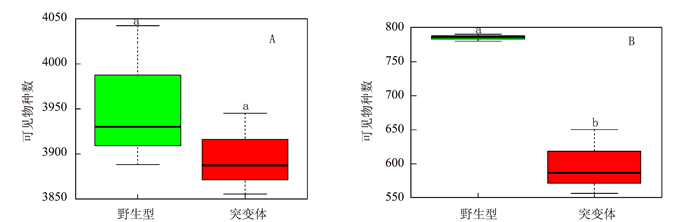
2.4 灌浆高峰期两种基因型水稻根际微生物多样性与根际分泌物
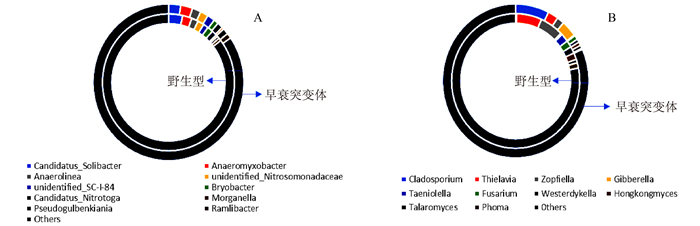
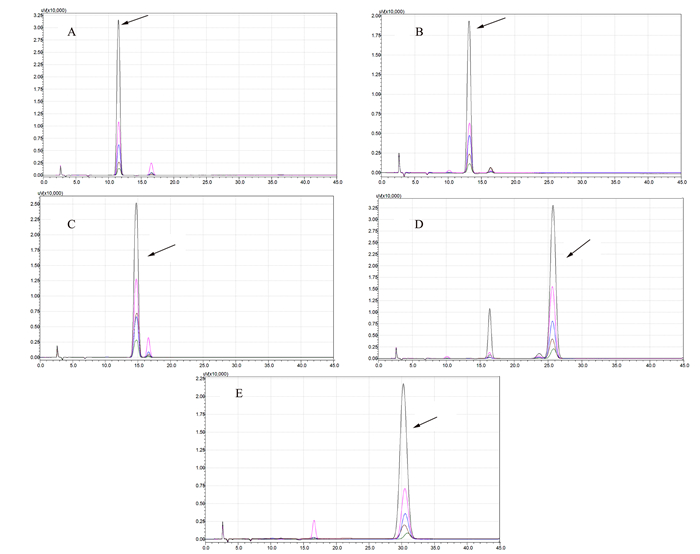
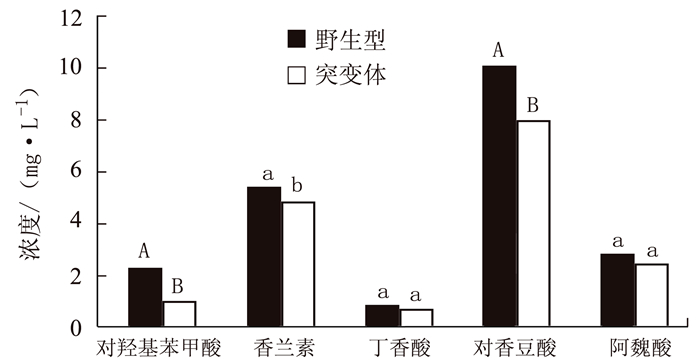
由图 4可见,突变体水稻根系土壤中细菌α-多样性与野生型差别不大(未达到显著差异)。但真菌多样性相比于野生型根际显著下降,平均下降约26.93%。由图 5可见,突变体根际土壤中的主要细菌组成及含量(TOP 10 groups)与野生型差异也不明显,但真菌群落结构发生变化,其中两种能够引起包括水稻在内许多常见植物病害的病原菌属Cladosporium和Gibberella的含量急剧上升,丰度相对于野生型分别上调88.79%和69.63%;两种真菌菌属Thielavia和Zopfiella含量显著下降,丰度相对于野生型分别下调22.34%和25.08%。其具体功能尚不清楚。表明不同基因型水稻根际能够“塑造”特定的根际微生物群落结构。由图 6和图 7可见,突变体与野生型水稻根际土壤中共鉴定出5种酚酸类物质,分别是羟基苯甲酸、香兰素、丁香酸、对香豆酸和阿魏酸。由图 8可见,灌浆高峰期突变体根际土壤中的酚酸含量相较于野生型发生显著变化;对羟基苯甲酸和对香豆酸含量极显著下降,香兰素含量显著下降。
2.5 早衰后根系活力下降与叶绿素及光合作用关系
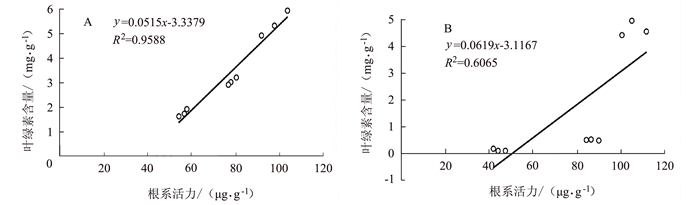
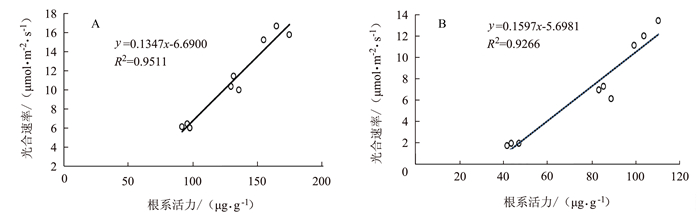
由图 9~10可见,孕穗期后野生型根系活力下降与叶绿素含量及光合速率下降呈明显的正相关关系,分别为R2=0.9588和R2=0.9511;但在突变体中其根系活力变化与叶绿素含量变化的相关性较差(R2=0.6065),但与光合速率变化仍具有较强的正相关性(R2=0.9266)。表明水稻根系活力变化与地上部功能叶作用发挥密切相关。
![]() 图 9 早衰后(孕穗期,抽穗期,灌浆高峰期)根系活力与叶绿素相关性分析注:A为野生型,B为OsVHA-A1基因缺失突变体。图 10同。Figure 9. Correlation between root activity and leaf chlorophyll content after senescence in different stages
图 9 早衰后(孕穗期,抽穗期,灌浆高峰期)根系活力与叶绿素相关性分析注:A为野生型,B为OsVHA-A1基因缺失突变体。图 10同。Figure 9. Correlation between root activity and leaf chlorophyll content after senescence in different stages3. 讨论与结论
水稻早衰是水稻实际耕作种植时常常发生的作物非正常生长现象,是由受自身遗传控制和外界环境和栽培条件(包括水分营养、光照条件、种植方式等)共同影响的复杂过程。通常表现为植株整体的生育期缩短,根系吸收能力与茎叶机能弱化并涉及许多生理生化代谢,诸如叶绿素含量减少、光合能力减弱、抗氧化酶类活性变化、活性氧物质(ROS)积累以及膜脂过氧化等[1-2, 4, 9]。一般来说,早衰常出现在水稻生育期的生殖阶段,即产量形成的关键时期。此时,过早的衰老进程启动会对植株的营养利用和生长发育造成严重影响,进一步阻碍水稻高产潜力的发挥。本研究认为OsVHA-A1基因缺失突变引起的水稻早衰现象是由自身基因缺陷控制的、并受根际微生物作用以及地下部与地上部间功能关系共同影响的复杂生理过程。结果表明,OsVHA-A1基因缺失突变会导致水稻植株生育后期出现明显的早衰性状表征。通过统计突变体与野生型的有效穗、结实率、千粒重等产量农艺性状,发现OsVHA-A1基因缺失突变还会引起水稻最终产量的急剧下降。课题组针对水稻全生育时期,测定突变体与野生型水稻叶片、根系中的抗氧化酶类活性变化、活性氧物质以及丙二醛积累。发现两种基因型水稻叶片与根系中的SOD酶、POD酶和CAT酶活性随生育期呈动态变化;孕穗期后,突变体叶片与根系中抗氧化保护酶的活性均显著低于野生型。同时,突变体叶片与根系中的H2O2含量、O2-产生率以及MDA含量相较于野生型显著上升,灌浆高峰期时差异最显著;对比野生型,突变体根系氧化衰老程度大于同时期的叶片。说明突变体株系的根系与叶片在生理水平上相较于野生型也存在提前和过度老化的表现。突变体早衰后相对于野生型SOD酶更快速地下降可能是响应水稻组织中更高的O2-积累并将其转换为毒性较低的H2O2;而POD酶以及CAT酶的快速降低则是突变体生育后期H2O2大量积累的重要因素。
为了验证上述这种特殊的早衰生理现象是否是与OsVHA-A1基因缺失突变有关,本试验针对苗期和灌浆高峰期利用实时荧光定量技术(QRT-PCR)和V-ATPase酶活性检测对比了根系与叶片衰老前后两个时期OsVHA-A1基因表达量与V-ATPase酶活性。发现OsVHA-A1基因在突变体与野生型水稻的根系和叶片(功能叶)中均能表达,灌浆高峰期OsVHA-A1基因的表达量与V-ATPase酶活性相对于苗期明显降低;突变体叶片和根系中OsVHA-A1基因表达量下调与V-ATPase酶活性降低幅度均显著大于野生型。值得注意的是,虽然突变体根系的ROS积累与膜脂过氧化水平明显高于其叶片,但其根系中OsVHA-A1基因在灌浆高峰期相对于苗期的下调表达量(Expression Fold)与V-ATPase酶活性降低程度甚至略低于叶片。由此可见,基因控制的抗氧化代谢失衡所导致的过量活性氧物质积累是OsVHA-A1基因缺失突变体早衰形成的主要原因。OsVHA-A1基因直接参与水稻衰老的调控过程,且OsVHA-A1基因缺失对突变体叶片衰老的促进作用要大于根系。
由此,可以推测OsVHA-A1基因缺失突变体水稻根系在生育后期的急剧衰老可能还受到遗传基因控制以外的环境因素的干扰。由于植物根系是生长在根际土壤这一复杂的环境介质中,土壤中水分、养分、根系分泌物以及微生物等作用就可能影响根系的生长发育并促进根系的衰老[43-45]。本课题组前期大量研究关于药用作物,如地黄太子参等连作过程中的酚酸类物质积累所介导根际土壤微生物组变化与连作障碍;酚酸类物质作为主要的自毒物质能够促进土壤病原微生物的大量增长[46-48]。酚酸类物质也是水稻主要的化感物质之一[49-50]。水稻可以通过分泌改变土壤根际微生物从而影响根系的养分吸收和生长[51]。根际微生物随水稻生育期发生变化从而体现水稻自身生长发育与根际微生物组结构的相关性[17]。因此,本试验分析了灌浆高峰期的根际土壤酚酸类物质与根际土壤微生物组多样性。结果表明,突变体与野生型根际细菌的多样性及含量差别不明显;但真菌组成差异显著。其中两种植物病原菌Cladosporium属和Gibberella属含量相对于野生型急剧上升。进一步在两种基因型水稻灌浆高峰期的根际土壤中共鉴定出5种土壤酚酸类物质,分别为对羟基苯甲酸、香兰素、丁香酸、对香豆酸和阿魏酸。通过建立标准品浓度-峰面积曲线,计算得到突变体根际土壤样品中的对羟基苯甲酸与对香豆酸含量极显著低于野生型,说明随着突变体水稻早衰的发生,其根际微生物群落结构也发生改变;可能的原因是由于特异病原菌对酚酸类物质的选择性利用而致其大量增长。但关于OsVHA-A1基因缺失是如何调控根系分泌物诱导根际微生物群落结构变化以及通过植物-根际分泌物-病原菌间互作加剧根系衰老的具体机制还有待研究。
部分学者认为成熟水稻穗粒中的碳水化合物60%~80%碳来源于抽穗后功能叶片的光合作用[52];功能叶片衰老每推迟1 d,产量约可增加1%~2%[53]。王复标等[54]在对旗叶早衰突变体水稻的研究中发现,旗叶早衰会造成功能叶光合速率的下降与叶绿体结构解构。除此之外,李木英等[55]通过比较17个不同类型杂交水稻组合初步探究了在限水条件与正常水分处理条件下,叶片衰老程度与叶片含N量的关系。根系活力下降所导致的叶片含N量减少是杂交水稻组合间表现不同程度早衰的重要原因。王彦荣等[56]研究不同衰老表型粳稻品种时发现,根系衰老的生理酶活性表现与激素调控机制要明显区别于叶片衰老。但二者彼此紧密相关,共同影响整个水稻籽粒灌浆过程。在本研究中,两种基因型水稻生育后期根系活力下降与叶绿素以及叶片光合速率减少存在一定的正相关性。说明地下部根系衰老与地上部叶片衰老具有一致性,二者生育后期生理功能的发挥彼此相互影响,共同导致水稻植株整体的老化。综上所述,OsVHA-A1基因缺失突变引起水稻早衰形成的潜在机理是基因缺失突变介导突变体水稻自身抗氧化代谢能力下降与活性氧物质过度积累,联同根系酚酸类分泌物选择性诱导病原菌增长,加剧其根系衰老,导致整体水稻植株的老化与早衰。因此,如何利用基因修复等分子手段预防早衰现象的发生以及使用生态学的办法(例如添加含有有益拮抗菌或促生菌的生物菌肥)调节早衰水稻根系土壤微生物组结构以达到缓解早衰和保持作物高产目的将会成为今后研究的重点方向,需要国内外广大学者进一步探索和实现。
-
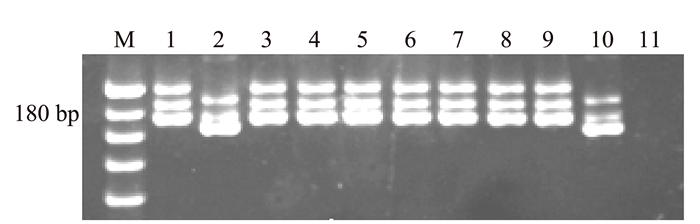
表 1 近等基因系和亲本的人工注射接菌及分子标记检测
Table 1 Artificial inoculation and molecular marker detection of NILs and parents
品种(系) 注射接菌结果(抗性) 分子检测结果 云引 高抗(HR) + LTH 高感(HS) - W13 抗病(R) + W14 高抗(R) + W15 抗病(R) + W17 抗病(R) + W18 中抗(MR) + W19 中抗(MR) + W22 抗病(R) + S1 高感(HS) - 注:①人工注射接菌时对接种叶片造成了伤口,病情略微偏重,本研究将调查结果中抗及以上的均记为抗病表型;②+表示阳性,-表示阴性。 表 2 供体亲本、受体亲本及近等基因系材料的主要农艺性状
Table 2 Agronomic traits of donor parents, receptor parents and NILs
品种(系) 株高/cm 分蘖数/个 穗长/cm 株总粒数/粒 株实粒数/粒 穗总粒数/粒 穗实粒数/粒 结实率/% 千粒重/g 云引 128.6 12.7 22.4 1967.3 1678.0 154.6 131.9 85.3 29.3 LTH 134.7 18.3 21.1 2584.6 2149.7 141.0 117.2 83.1 26.6 W13 133.2 17.6 22.2 2306.8 1923.4 130.5 108.8 83.3 27.8 W14 134.5 19.3 23.0 2798.6 2302.2 144.7 119.1 82.2 27.2 W15 131.2 18.6 20.5 2524.6 2083.8 135.2 111.6 82.5 26.7 W17 135.4 17.8 20.8 2396.3 2009.0 133.9 112.3 83.8 27.1 W18 131.9 18.3 21.4 2448.6 2035.7 133.5 111.0 83.1 26.9 W19 135.8 17.9 22.5 2502.9 2062.5 139.5 115.0 82.4 27.0 W22 130.9 18.6 21.1 2675.0 2209.9 143.2 118.3 82.6 27.1 表 3 近等基因系与轮回亲本LTH之间的多态性标记及其遗传背景恢复率
Table 3 Genetic background recovery rates and polymorphic markers between NILs and LTH
品系 多态性标记数 恢复率/% W13 2 98.61 W14 2 98.61 W15 3 97.61 W17 3 97.61 W18 4 97.22 W19 1 99.31 W22 1 99.31 -
[1] 薛恒.米业产业化经营:米业产品的营销创新[J].中国稻米, 2003, 9(5):28-29. DOI: 10.3969/j.issn.1006-8082.2003.05.016 [2] 刘萌.培育水稻空育131BL多系品种供体亲本抗稻瘟病性鉴定及目的基因分子标记分析[D].哈尔滨: 黑龙江大学, 2012. [3] 马玉银, 左示敏, 张再金, 等.水稻近等基因系构建及其应用[J].安徽农业科学, 2008, 36(17):7167-7168. DOI: 10.3969/j.issn.0517-6611.2008.17.049 [4] 章琦, 杨文才, 施爱农, 等. 3个粳稻抗白叶枯病近等基因系的构建[J].作物学报, 1998, 24(6):799-804. DOI: 10.3321/j.issn:0496-3490.1998.06.026 [5] 褚晋, 何鹏飞, 赵正龙, 等. 3套水稻近等基因系对两个病圃稻瘟病菌的抗性评价[J].江西农业学报, 2014, 26(7):50-54. DOI: 10.3969/j.issn.1001-8581.2014.07.014 [6] 朱小源, 杨祁云, 杨健源, 等.抗稻瘟病单基因系对籼稻稻瘟病菌小种鉴别力分析[J].植物病理学报, 2004, 34(4):361-368. DOI: 10.3321/j.issn:0412-0914.2004.04.013 [7] 赵霏, 任三娟, 郭泽建, 等.利用近等基因系研究豌豆铁蛋白基因对水稻重要生物学特性的影响[J].农业生物技术学报, 2011, 19(1):63-68. DOI: 10.3969/j.issn.1674-7968.2011.01.009 [8] 凌忠专, 蒋琬如, 王久林, 等.水稻品种丽江新团黑谷普感特性的研究和利用[J].中国农业科学, 2001, 34(1):116-116. DOI: 10.3321/j.issn:0578-1752.2001.01.025 [9] TEMNYKH S, DeCLERK G, LUKASHOVA A, et al. Computational and experimental analysis of microsatellites in rice (Oryza sativa L.):frequency, length variation, transposon associations, and genetic marker potential[J]. Genome Research, 2001, 11(8):1441-1452. DOI: 10.1101/gr.184001
[10] 中华人民共和国农业部.水稻品种鉴定技术规程SSR标记法: NY/T 1433-2014[S].北京: 中国标准出版社, 2014: 9-13. [11] Cold Spring Harbor Laboratory, Oregon State University, EMBL-EBI. SSR Markers Resource-Microsatellite Markers[R/OL].(2016-08-26)[2018-06-13].http://www.gramene.org/microsat/ssr.html
[12] 陈锦文, 朱永生, 张建福, 等.四个杂交水稻骨干恢复系的多态性分析[J].福建农业学报, 2014, 29(4):319-323. DOI: 10.3969/j.issn.1008-0384.2014.04.005 [13] 阳海宁, 韦绍丽, 李孝琼, 等.标记辅助培育水稻抗稻褐飞虱和稻白叶枯病基因聚合系[J].分子植物育种, 2010, 8(1):11-19. http://d.old.wanfangdata.com.cn/Periodical/fzzwyz201001004 [14] 沈新莲, 张天真.作物分子标记辅助选择育种研究的进展与展望[J].高技术通讯, 2003, 13(2):105-110. DOI: 10.3321/j.issn:1002-0470.2003.02.023 [15] XU Y, CROUCH J H. Marker-assisted selection in plant breeding from publication to practice[J]. Crop science, 2008, 48(2):391-407. DOI: 10.2135/cropsci2007.04.0191
[16] LUO Y C, SANGHA J S, WANG S H, et al. Marker-assisted breeding of Xa4, Xa21 and Xa27 in the restorer lines of hybrid rice for broad-spectrum and enhanced disease resistance to bacterial blight[J]. Molecular Breeding, 2012, 30(4):1601-1610. DOI: 10.1007/s11032-012-9742-7
[17] 郑康乐, 黄宁.标记辅助选择在水稻改良中的应用前景[J].遗传, 1997, 19(2):40-44. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=QK199700879646 -
期刊类型引用(9)
1. 郭河麟,郭河燕,石玉琴,辛镇忠,王翔,杨佳丽,王腾飞,王愈. 壶瓶枣裂果多糖咀嚼片配方优化及其体外抗氧化活性研究. 保鲜与加工. 2025(02): 87-98 .  百度学术
百度学术
2. 王晨,冯作山,苏合拉提·吐尔逊太,杨莲,胡长江,刘明臣,李硕,尼格尔热依·亚迪卡尔. 青熟期托克逊杏咀嚼片湿法压片法的制备工艺研究. 食品研究与开发. 2024(06): 174-183 .  百度学术
百度学术
3. 周迪,姚可欣,于清华,吕博威,王永奇,于建. 双层包埋维生素A微胶囊的压片性能和稳定性研究. 中国食品添加剂. 2024(09): 188-196 .  百度学术
百度学术
4. 丁雯,崔慧莹,高振珅,王慧,王悦尚. 吡喹酮咀嚼片的制备及其质量评价. 山东畜牧兽医. 2024(09): 1-4+7 .  百度学术
百度学术
5. 赵宇慧,张丽,宋玉霞,甘晓燕,聂峰杰,巩檑. 响应面法优化肉苁蓉咀嚼片配方及品质检测. 食品工业. 2022(01): 130-135 .  百度学术
百度学术
6. 刘淑敏,张淑君,梁绮晴,陈文泉,阮艳红,杨娟. 白芸豆甘蔗渣咀嚼片直接压片法的制备工艺研究. 食品研究与开发. 2021(17): 93-100 .  百度学术
百度学术
7. 戴春. 麦麸膳食纤维对控制中老年糖尿病患者血糖效果研究. 中国食物与营养. 2020(03): 57-60 .  百度学术
百度学术
8. 汤葆莎,赖谱富,李怡彬,吴俐,翁敏劼,郑恒光. 芙蓉李咀嚼片酚类物组成及其生物活性. 福建农业学报. 2020(07): 788-794 .  本站查看
本站查看
9. 刘伟,杨华峰,屈世龙,杜荣荣,薛淑花,李芳,孔令明. 基于模糊数学评价结合混料设计优化葡萄籽超微粉压片糖果工艺. 新疆农业大学学报. 2020(04): 281-289 .  百度学术
百度学术
其他类型引用(7)




 下载:
下载: