Phenotype and Interior of Endangered Species, Semilabeo obscurus
-
摘要: 分析暗色唇鲮Semilabeo obscurus的表型性状空间结构及内部器官组成特征,为暗色唇鲮的快速分类鉴别和种质保护工作提供参考。采用鱼类传统形态学和现代框架特征研究方法,通过统计学及SPSS因子分析法解构其表型结构特点。结果表明:暗色唇鲮体长与全长、体高、头长、头高、头宽、尾柄长、尾柄高,头长与吻长、眼径、眼间距、尾柄长、尾柄高,尾柄长与尾柄高,头高与头宽以及21项框架距离与体长均呈线性相关关系。头高/头宽、尾柄长/尾柄高及尾鳍基部上端至臀鳍基部末端距离(D5-7)与体长性状关系相对稳定且线性回归相关性较强。主成分特征向量以D4-5(背鳍基部末端-尾鳍基部上端)、D4-6(背鳍基部末端-尾鳍基部下端)、D4-7(背鳍基部末端-臀鳍基部末端)、D3-8(背鳍起点-臀鳍起点)、D3-4(背鳍起点-背鳍基部末端)和D5-7(尾鳍基部上端-臀鳍基部末端)的载荷量绝对值最大,且均为正相关关系,集中反映鱼类尾柄部分的表型特征信息。表型结构性状多维分析结果提示,暗色唇鲮头高/头宽(0.91~0.95)、尾柄长/尾柄高(1.37~1.47)以及尾鳍基部上端至臀鳍基部末端距离与体长比(0.241 3~0.255 3)是代表暗色唇鲮表型结构特征的性状参数。暗色唇鲮内部组织器官组成及结构布局同一般鲤科鱼类相似,具有肠细长、膘较短小的特征,肠长指数14.15~15.76(15.14),非成熟期个体肠管占腹腔体积的80%以上,膘长度约为鱼体长的14%、腹腔长度的50%。暗色唇鲮的内外结构体现生物体对环境的适应性进化,具有较高研究价值。Abstract: Phenotype and interior of an endangered species, Semilabeo obscurus, were studied to establish a rapid identification and classification method to facilitate conservation of the germplasm. Traditional morphological and advanced methodologies were applied, and data subjected to statistics and SPSS factor analyses. Linear relationships were found between the body length and the total length, body height, head length, head height, head width, caudal length, orcaudal height, between the head length and the proboscis length, eye diameter, distance between eyes, caudal length, orcaudal height, between the caudal length and the caudal height, between the head height and the head width, as well as between the 21 frame distance and the body length of S. obscurus. Stable linear regression correlations existed between the body length and the head height/head width ratio, caudal length/caudal depth ratio or D5-7. The principal component feature vector had the greatest absolute value on the loads of D4-5, D4-6, D4-7, D3-8, D3-4 and D5-7, and they correlated. It reflected the characteristic phenotype of the tail section of the fish.Amultidimensional analysis on the phenotype suggested that the ratios of the head height/head width(0.91-0.95), caudal length/caudal height(1.37-1.47) and D5-7/body length(0.241 3-0.255 3) could be the key indicators for the properties. In general, the composition and structure of the internal organs of S. obscurus were similar to those of Cyprinidae, having long and thin intestines with short and small swim bladders and an intestinal index of 14.15-15.76 (averaging 15.14). The intestines occupied more than 80% of the abdominal cavity of animmature fish; and the length of the bladder, about 14% of the fish body length or 50% of the abdominal cavity length.The information obtained showed the evolution of S. obscurus as it adapted to the environmental changes.
-
Keywords:
- Semilabeo obscurus Lin /
- phenotype /
- internal structure
-
番茄斑萎病毒Tomato spotted wilt orthotospovirus(TSWV)是Perbunyaviridae科, Tospovirus属的代表种,主要由西花蓟马以持久增殖型方式进行传播。TSWV可以侵染85个科1090种植物,是目前寄主最广泛的植物病毒[1]。TSWV能够危害蔬菜、花卉及多种粮食作物,如番茄、辣椒、马铃薯、花生、莴苣、豌豆、烟草、菊花、银莲花、白日草、大岩桐、大丽花及仙客来等,对许多经济作物及庭院植物造成严重经济损失[2],已被列为全球十大植物病毒之一,危害性仅次于位列榜首的烟草花叶病毒Tobaco mosaic virus(TMV)[3]。1944年,在我国成都地区的番茄上首次发现该病毒,随后在四川、广东、云南、北京、天津、宁夏等地相继发现[4]。近年来,该病毒在中国部分地区的危害逐渐加重。基于对该病毒的危险评估,我国于2007年将TSWV列为进境植物检疫性有害生物[4]。
TSWV的基因组为三分体RNA,根据其分子量大小,分别命名为L RNA、M RNA和S RNA,3个片段5'端和3'端有8个互补并高度保守碱基,5'端为:5'-UCUCGUUA,3'端为3'-AGAGCAAU,形成假环状结构[5]。L RNA为负义链,而M RNA和S RNA是双义链[6]。L RNA的互补链中含有一个开放阅读框(ORF),用于编码RNA依赖性RNA聚合酶(RdRp)[7-8]。M RNA和S RNA均含有由富含A-U的基因间隔区分隔的两个ORF。M RNA中病毒链编码运动蛋白NSm[9-12],而互补链编码糖蛋白Gn和Gc[13-14]。S RNA中病毒链编码RNA沉默抑制子蛋白NSs[15-16],而互补链编码核衣壳蛋白N [17]。N蛋白有多个与RNA结合的位点,可以以多聚体的形式存在参与RNPs的组装[18-19]。N蛋白在寄主植物内可以与TSWV的糖蛋白Gn/Gc互作,可能与病毒粒子的装配相关[20]。在活体及离体实验中,N蛋白均可与TSWV的运动蛋白NSm发生互作[21]。
目前,国内外对番茄斑萎病毒病的防治开展了较多研究,多以控制传毒介体为主要防治手段。加强对TSWV的监测预报并且通过治虫防病是主要防控措施。所以,在田间对辣椒、番茄等作物进行病毒监测及检测尤为重要。目前,对TSWV进行检测的方法主要有RT-PCR、qPCR、in-ELISA、dot-ELISA和电镜观察等。其中,利用抗体进行血清学检测可以快速监测田间番茄、辣椒及西花蓟马的带毒率。而且血清学检测具备高效、快速、灵敏度高、成本低廉的特点。因此,本研究原核表达TSWV核衣壳蛋白N、糖蛋白Gn,并且免疫新西兰大白兔,制备了多克隆抗体,并通过Western blot及间接ELISA检测对抗体的特异性及效价进行了测定,为田间番茄斑萎病毒病的快速检测和预报提供技术支持。
1. 材料与方法
1.1 材料
感染TSWV的病株采自云南昆明,通过三生烟和鉴别寄主纯化病毒后,汁液摩擦接种保存在本氏烟上Nicotiana benthamiana,Escherichia coli DH5α以及Rosetta菌株置于-80℃保存。
Trizol、Gateway系统载体pDONR221和pDEST17、BP Clonase Enzyme Mix、LR Clonase Enzyme Mix购自Invitrogen公司;EasyTaq® DNA Polymerase、TransStart® TopTaq DNA Polymerase、Trans2K Plus DNA Marker购自TransGen Biotech公司;蛋白Marker购自Thermo公司;HiScript 1st Strand cDNA Synthesis Kit购自Vazyme公司;弗氏佐剂、不完全佐剂、IPTG、羊抗兔IgG、BCIP/NBT购自Sigma公司;硝酸纤维素膜购自Amersham Pharmacia公司。
PCR引物根据GenBank中TSWV N已知基因序列(GenBank No. JF960235.1), Gn已知基因序列(GenBank No. JF960236.1),设计相应引物,由生工生物工程(上海)股份有限公司合成,见表 1。
表 1 PCR引物Table 1. PCR primers引物名称 引物序列5'-3' 引物用途 N-F GGG GAC AAG TTT GTA CAA AAA AGC AGG CTT CAT GTC TAA GGT TAA GCT CAC N的扩增 N-R GGG GAC CAC TTT GTA CAA GAA AGC TGG GTC TTA AGC AAG TTC TGC AAG TTT TG N gene cloning Gn-F GGG GAC AAG TTT GTA CAA AAA AGC AGG CTT CAT GGA TCA TCC TGA GGT TTA TG Gn的扩增 Gn-R GGG GAC CAC TTT GTA CAA GAA AGC TGG GTC ACC AGG TTT TTT TAT CAA ATA AC Gn gene cloning 1.2 方法
1.2.1 TSWV N和Gn基因原核表达载体的构建
从感病的辣椒叶片中提取RNA,应用HiScript 1st Strand cDNASynthesis Kit反转录试剂盒合成cDNA,以cDNA为模板进行PCR扩增反应,获得目的基因N和Gn。按Invitrogen公司BP Clonase Enzyme Mix说明书,分别将纯化回收后的N和Gn基因产物与pDONR221入门载体进行BP重组反应,PCR鉴定获得阳性克隆。菌落PCR的反应体系为:95℃预变性5 min;30个循环:95℃ 30 s、55℃ 30 s、72℃ 1 min;72℃继续延伸10 min;16℃保存。提取入门质粒pDONR221-N和pDONR221-Gn,并按Invitrogen公司LR Clonase Enzyme Mix说明书,分别将质粒和目的载体pDEST17进行LR重组,菌落PCR鉴定阳性克隆并提取质粒。阳性克隆菌液送生工生物工程(上海)股份有限公司测序,验证其基因序列的正确性。
1.2.2 TSWV N和Gn蛋白的原核表达
将质粒pDEST17-N和pDEST17-Gn转化到大肠杆菌表达菌株Rosetta细胞内,菌落PCR筛选阳性克隆,菌落PCR的反应条件同1.2.1。将阳性克隆菌液按照1: 100的比例接种到10 mL的LB培养基中,28℃培养菌液使菌液OD600的数值在0.6~0.8,再加入终浓度1 mmol·L-1的IPTG,在28℃ 220 r·min-1的条件下对菌体进行5 h的蛋白表达诱导。离心,收集菌体,加入1×SDS上样缓冲液,沸水加热变性10 min离心,取10 μL上清进行聚丙烯酰胺凝胶电泳分析。电泳结束后考马斯亮蓝染色、凝胶脱色、观察蛋白表达情况并比对大小。
1.2.3 TSWV N和Gn蛋白抗血清制备
28℃条件下,220 r·min-1诱导100 mL菌液5 h,8 000 g离心收集诱导菌液,加入10 mL 0.01 mol·L-1 PBS重悬菌体,加入5×SDS上样缓冲液,沸水中煮10 min,进行SDS-PAGE凝胶电泳。电泳结束后,将凝胶浸泡在预冷的KCl(0.1 mol·L-1)溶液中进行染色,并将目的蛋白条带切割用于免疫新西兰白兔。首次免疫时,将目的蛋白胶条放于研钵内,加入适量的生理盐水以及弗氏完全佐剂充分研磨,将混匀乳化后的蛋白多点注射入新西兰大白兔的皮下肌肉。之后的加强免疫过程中,加入生理盐水和弗氏不完全佐剂进行研磨,免疫新西兰大白兔的皮下肌肉。每隔7 d免疫1次,共免疫5次,动脉取血后置于37℃静止1 h,4℃过夜,离心收集血清即为制备的抗血清。制备好的抗血清加入质量浓度为0.2 mg·mL-1叠氮化钠,置于-80℃长期保存。
1.2.4 Western blot检测多克隆抗体的特异性
参照John等[22]的方法提取携带TSWV的辣椒及健康辣椒的总蛋白,进行SDS-PAGE电泳。将NC膜放在转移缓冲液中浸泡20 min;湿式转移法恒压15 V,60 min进行转膜。将NC膜放入封闭液中37℃孵育1 h。TTBS洗膜3次,每次间隔5~10 min;将NC膜放入抗血清溶液(1: 2 000)中,37℃下孵育1 h。TTBS洗膜3次,每次间隔5~10 min。将NC膜放入碱性磷酸酶标记的羊抗兔IgG溶液(1: 10 000)中,37℃下孵育1 h。TTBS洗膜3次,每次间隔5~10 min;最后将NC膜浸没在20 mL的底物显色稀释液中2 min,然后加入40 μL NBT/BCIP的显色液,混合均匀,避光静止至NC膜显色,再将NC膜放入去离子水中终止反应。
1.2.5 间接ELISA检测抗体效价
利用间接ELISA进行抗体效价的测定。称量新鲜的感染TSWV及健康的辣椒叶片各1 g于研钵中,加入1 mL碳酸包被液充分研磨后,12 000 r·min-1离心2 min。在酶联板上,每孔加入100 μL的样品溶液。密封酶联板,将其置于37℃恒温培养箱中进行1 h的封闭孵育。快速垂直倾倒抗原溶液,使用PBST缓冲液洗涤酶联板5次,每次5 min。依次加入梯度稀释(1: 100、1: 200、1: 400、1: 800、1: 1 600、1: 3 200、1: 6 400、1: 12 800)的N和Gn多克隆抗体,每个稀释梯度3个重复,密封酶联板置于37℃恒温培养箱中进行1 h孵育。PBST洗涤5次,每次5 min。向每孔加入100 μL稀释10 000倍的羊抗兔IgGs,密封后置于37℃恒温培养箱中进行2 h孵育。PBST洗涤5次,每次5 min。最后每孔加入100 μL底物,避光置于37℃的恒温箱中,约5~10 min出现显色,立即用酶标仪在波长405 nm下读取数据。根据阳性对照:阴性对照>2倍以上的抗体最大稀释倍数为抗体的效价。
1.2.6 Dot-ELISA检测TSWV
分别取感病和健康的辣椒叶片0.2 g,并加入1 mL PBS于研钵中进行研磨,12 000 r·min-1离心5 min后,取2 μL上清液加入对应的NC膜上,37℃孵育30 min;将NC膜浸入含50 mg·mL-1脱脂奶粉中,37℃封闭30 min;分别放入N、Gn的抗体(1: 3 000)中,37℃孵育30 min;PBST洗涤3次,每次5 min;取出NC膜,放入AP酶标的羊抗兔IgGs(1: 10 000),37℃孵育30 min;PBST洗涤5次,每次5 min;滤纸吸干NC膜上的液体后再将其置于滴加适量NBT/BCIP的底物显色稀释液中,待样品显色,而阴性无显色现象时,停止反应,记录试验结果。
2. 结果与分析
2.1 TSWV-N和Gn基因的克隆及其原核表达载体的构建
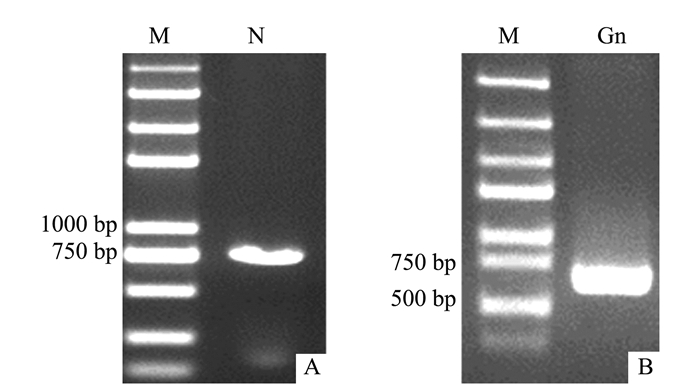
从感病的辣椒叶片中提取总RNA,利用TSWV的N基因的特异性引物N-F、N-R及TSWV Gn基因的特异性引物Gn-F、Gn-R进行RT-PCR分别获得777 bp和639 bp大小片段(图 1),Gateway重组获得原核表达载体pDEST17-N和pDEST17-Gn,菌液PCR验证同样获得777 bp和639 bp大小片段(图片未提供)。经测序,验证了N和Gn原核表达载体的正确性。
2.2 TSWV-N和TSWV-Gn蛋白的诱导表达
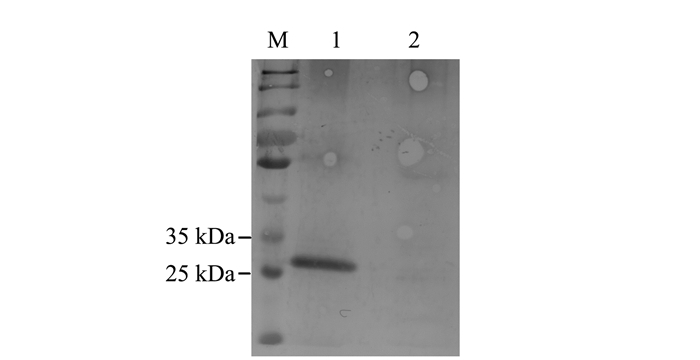
重组质粒pDEST17-N和pDEST17-Gn分别转入原核表达菌株Rosetta后,筛选阳性克隆,使用终浓度为1 mmol·L-1IPTG进行诱导,SDS-PAGE检测发现,与未诱导的菌液相比,含pDEST17-N、pDEST17-Gn的菌液分别在28 kDa和25 kDa附近有明显的目的蛋白条带(图 2),与预期的蛋白大小一致,说明目的蛋白被诱导表达。
2.3 Western blot检测多克隆抗体的特异性
为检测抗体的特异性,分别以感染TSWV和健康的辣椒总蛋白为样品,抗N和Gn蛋白多克隆抗体为一抗,羊抗兔IgG为二抗,进行Western blot分析。结果显示N抗体能特异性识别感病植株中28 kDa蛋白,而健康辣椒样品没有检测到该蛋白条带(图 3),说明获得的抗N蛋白的多克隆抗体具有很好的特异性。而Gn抗体没有检测到明显的条带(数据未列出),可能原因为感病植株Gn的表达量低,Western blot试验中,Gn抗体不能敏感地识别到抗原。
2.4 间接ELISA检测抗体的效价
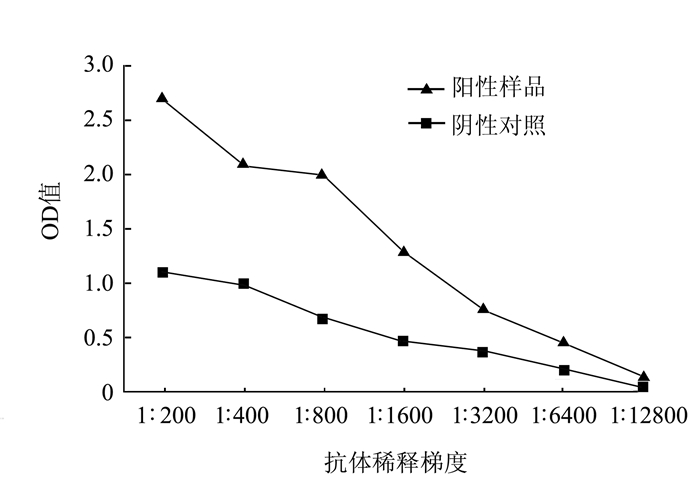
分别以感病和健康辣椒作为抗原,N和Gn免疫抗体作为一抗,利用in-ELISA的方法对抗体效价进行检测,试验重复3次。数据显示,质量浓度为1 mg·mL-1的带毒辣椒汁液可以与稀释12 800倍的N抗体产生阳性免疫反应,表明N抗体效价为1: 12 800(图 4)。而Gn抗体在稀释200倍的情况下仍不能与抗原反应显色,无法检测出Gn的效价。
2.5 Dot-ELISA检测TSWV
分别以感病和健康辣椒为抗原,N和Gn免疫抗体作为一抗进行Dot-ELISA检测。结果表明,仅以N抗体为抗的试验中,感病辣椒出现阳性的免疫斑点,而健康辣椒呈现阴性反应(图 5),而Gn抗体试验中阳性样品无免疫斑点。则外壳蛋白N抗体能很好地用于检测TSWV。
3. 讨论与结论
近年来,番茄斑萎病毒病害在我国云南地区的多种蔬菜和花卉作物上连年发生,造成了巨大的减产和经济损失。因该病毒病害的寄主范围广,危害性大,已被列为世界危害最大的植物病毒病害之一[23]。本研究克隆了TSWV的N和Gn基因,通过Gateway技术将基因构建到原核表达载体pDEST17上,再将其转入Rosetta细胞内,IPTG诱导表达蛋白,并免疫新西兰大白兔获得多克隆抗体。与纯化植物病毒粒子为抗原制备抗体的传统方法相比,利用大肠杆菌原核表达病毒蛋白作为抗原制备抗体,抗原易获取、纯度高,抗体特异性高,不易出现血清学的交叉反应。经Western blot检测抗N蛋白的多克隆抗体具有很好的特异性,并且抗体效价较高,既可用于TSWV在田间的诊断,又可为开展病毒在介体昆虫细胞的定位、病毒和介体的互作研究提供实验材料。而膜多糖蛋白Gn多克隆抗体在Western blot及间接ELISA试验中均未检测出明显的特异性和效价。TSWV N和Gn蛋白为结构蛋白[13-14, 17],理论上两个蛋白都能够作为病毒检测的理想靶标。但本研究仅证明了N蛋白的多克隆抗体可用,Gn蛋白的表达量远低于N蛋白的表达量。本研究同时制备了TSWV NSs和NSm非结构蛋白的多克隆抗体,但在病株诊断灵敏度检测水平远低于N蛋白抗体的检测水平。因此田间诊断TSWV的发生情况,可优先选用N蛋白的多克隆抗体,并可将其加工成试纸条进行田间病毒样品的快速检测。本研究利用制备的多克隆抗体建立了dot-ELISA检测TSWV的技术。此方法只需极少量的样品且操作简单快捷,格外适合于数量稀少的样品检测。
于翠等[24]通过原核表达载体pET-32a,表达纯化了TSWV N蛋白,并制备了单克隆抗体,可用于田间病毒样品的检测。但单抗制备过程周期长,成本高,需要获得多株细胞株验证抗体的实用性。同时制备的多克隆抗体能识别多个抗原表位,制备周期短,成本低,可更好地应用于田间病株的检测,对TSWV病毒病害的检测、预测预报和防控具有重要意义。
-
表 1 暗色唇鲮可量性状间的比值及其相关关系
Table 1 Ratios and correlations of measurablemorphological properties of S. obscurus
可量性状 比值(平均) 标准差 相关方程 R2 体长Sl/全长Tl 0.75~0.79(0.77) 0.0099 Tl=1.2750Sl+5.6414 0.9970 体长Sl /体高Bd 3.62~4.64(4.14) 0.3885 Bd=0.2457Sl-0.5363 0.8861 体长Sl /头长Hl 4.11~4.46(4.27) 0.0987 Hl=0.2254Sl+1.9099 0.9922 体长Sl /头高Hd 5.76~6.74(6.28) 0.3237 Hd=0.1619Sl-0.5022 0.9627 体长Sl /头宽Hw 5.50~6.20(5.81) 0.2269 Hw=0.1694Sl+0.5877 0.9802 体长Sl /尾柄长Cl 4.99~5.63 (5.33) 0.1865 Cl=0.1892Sl-0.7637 0.9863 体长Sl /尾柄高Cd 7.16~7.91(7.60) 0.2166 Cd=0.1348Sl-0.6647 0.9893 头长Hl/吻长Pl 1.77~1.91(1.83) 0.0451 Pl=0.5678Hl-1.0664 0.9933 头长Hl/眼径Ed 6.49~7.19(6.93) 0.2071 Ed=0.1366 Hl +0.3816 0.9933 头长Hl/眼间距Ei 1.79~2.30(2.05) 0.1881 Ei=0.5144Hl -1.1854 0.8989 头长Hl/尾柄长Cl 1.19~1.32(1.25) 0.0462 Cl=0.8351Hl -2.1524 0.9847 头长Hl/尾柄高Cd 1.70~1.93(1.78) 0.0650 Cd=0.5956Hl -1.6706 0.9887 尾柄长Cl/尾柄高Cd 1.37~1.47(1.43) 0.0291 Cd=0.7112 Cl -0.0537 0.9987 头高Hd /头宽Hw 0.91~0.95(0.93) 0.0171 Hw=1.0353Hd+1.5313 0.9962 表 2 暗色唇鲮框架数据与体长的比值及其相关关系
Table 2 Ratios and correlations between body length andmeasurements on frame of S. obscurus
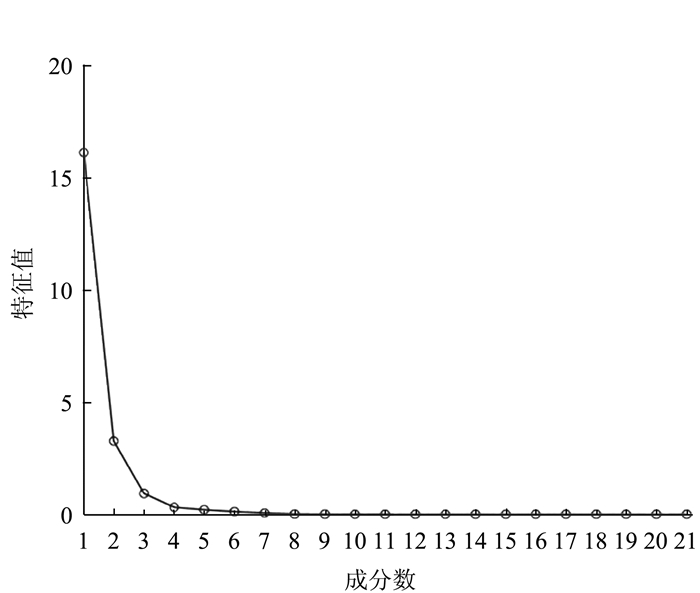
表型框架因子 因子/体长(平均) 标准差 相关方程 R2 D1-2 0.2249~0.2570(0.2379) 0.0120 D1-2=0.2362Sl+0.2733 0.9674 D1-9 0.5121~0.5632(0.5363) 0.0162 D1-9=0.5302Sl+1.2362 0.9876 D1-10 0.2180~0.2365(0.2282) 0.0049 D1-10=0.2202Sl+1.7578 0.9930 D2-3 0.2334~0.2818(0.2534) 0.0176 D2-3=0.2512Sl+0.3859 0.9436 D2-8 0.5070~0.5415(0.5238) 0.0102 D2-8=0.5129Sl+2.3234 0.9941 D2-9 0.3103~0.3459(0.3265) 0.0118 D2-9=0.3260Sl+0.0302 0.9821 D2-10 0.1021~0.1253(0.1119) 0.0066 D2-10=0.1068Sl+1.0371 0.9631 D3-4 0.1479~0.1580(0.1533) 0.0033 D3-4=0.1518Sl+0.3477 0.9927 D3-7 0.4128~0.4449(0.4265) 0.0089 D3-7=0.4233Sl+0.6887 0.9928 D3-8 0.3445~0.3946(0.3680) 0.0175 D3-8=0.3677Sl-0.0575 0.9696 D3-9 0.2242~0.2837(0.2488) 0.0248 D3-9=0.2552Sl+1.5375 0.8900 D4-5 0.4033~0.4772(0.4353) 0.0263 D4-5=0.4370Sl-0.5010 0.9530 D4-6 0.4276~0.4830(0.4535) 0.0199 D4-6=0.4501Sl+0.5965 0.9749 D4-7 0.2786~0.3321(0.3014) 0.0204 D4-7=0.3079Sl-1.4927 0.9443 D4-8 0.2415~0.2824(0.2580) 0.0164 D4-8=0.2578Sl-0.0571 0.9531 D5-6 0.1386~0.1635(0.1490) 0.0091 D5-6=0.1479Sl+0.1965 0.9594 D5-7 0.2413~0.2553(0.2493) 0.0038 D5-7=0.2429Sl+1.3898 0.9958 D6-7 0.1663~0.2008(0.1800) 0.0141 D6-7=0.1838Sl-0.9206 0.9276 D7-8 0.0846~0.0937(0.0891) 0.0027 D7-8=0.0852Sl+0.8570 0.9876 D8-9 0.1859~0.2112(0.1960) 0.0071 D8-9=0.1971Sl-0.2516 0.9831 D9-10 0.2712~0.3312(0.2981) 0.0235 D9-10=0.3016Sl-0.9258 0.9231 表 3 解释的总方差
Table 3 Total variance explained
成分 特征根 方差贡献率
/%累积贡献率
/%1 16.117 76.748 76.748 2 3.260 15.526 92.274 3 0.925 4.404 96.678 4 0.309 1.472 98.150 5 0.199 0.948 99.098 6 0.120 0.571 99.669 7 0.057 0.273 99.942 8 0.009 0.045 99.987 9 0.003 0.013 100.000 表 4 性状相关矩阵的特征向量
Table 4 Correlation matrix on characteristic vectors of morphological characteristics
表型框架因子 成分矩阵 旋转成分矩阵 成分1 成分2 成分1 成分2 D1-2 0.979 -0.129 0.983 -0.090 D1-9 0.983 0.163 0.976 0.202 D1-10 -0.338 0.792 -0.369 0.777 D2-3 0.983 -0.136 0.987 -0.097 D2-8 0.861 0.438 0.842 0.472 D2-9 0.991 0.075 0.988 0.115 D2-10 0.930 -0.120 0.934 -0.083 D3-4 -0.047 0.897 -0.083 0.894 D3-7 0.878 0.427 0.860 0.462 D3-8 0.994 0.000 0.993 0.040 D3-9 0.979 -0.197 0.986 -0.157 D4-5 0.992 -0.049 0.994 -0.009 D4-6 0.996 -0.009 0.995 0.031 D4-7 0.990 -0.076 0.992 -0.036 D4-8 0.982 -0.148 0.987 -0.108 D5-6 0.951 -0.190 0.957 -0.152 D5-7 0.455 0.853 0.421 0.871 D6-7 0.978 -0.184 0.984 -0.145 D7-8 -0.005 0.632 -0.030 0.631 D8-9 0.915 0.299 0.902 0.335 D9-10 0.989 -0.135 0.994 -0.096 -
[1] 乐佩琦.中国动物志硬骨鱼纲鲤形目(下卷)[M].北京:科学出版社, 2000:171-272. [2] 周解, 张春光.广西淡水鱼类志[M].第2版.南宁:广西人民出版社, 2006:276-279. [3] 褚新洛, 陈银瑞.云南鱼类志(上册)[M].北京:科学出版社, 1990:238-243. [4] 郑慈英.珠江鱼类志[M].北京:科学出版社, 1989:210-213. [5] 乐佩琦, 陈宜瑜.中国濒危动物红皮书鱼类卷[M].北京:科学出版社, 1998:167-169. [6] 汪松, 解焱.中国物种红色名录[M].北京:高等教育出版社, 2009. [7] 裴裕松, 周解.广西珍稀水生生物识别手册[M].南宁:广西人民出版社, 2007:121-123. [8] 刘霆, 杨兴, 李道友, 等.唇鲮的引种驯养技术研究[J].水利渔业, 2008, 28(1):56-98. DOI: 10.3969/j.issn.1003-1278.2008.01.018 [9] 安苗, 姜海波, 姜志强, 等.唇鲮肌肉中营养成分分析与品质评价[J].大连水产学院学报, 2010, 25(1):88-92. DOI: 10.3969/j.issn.1000-9957.2010.01.019 [10] 安苗, 潘光.唇鲮染色体核型研究[J].山地农业生物学报, 2008, 27(6):508-511. DOI: 10.3969/j.issn.1008-0457.2008.06.008 [11] 李建光, 刘霆, 胡世然, 等.唇鲮的驯化转食[J].水产科技情报, 2011, 38(4):61-66. http://d.old.wanfangdata.com.cn/Periodical/sckjqb201002005 [12] 刘霆, 李建光, 胡世然, 等.唇鲮的人工繁殖技术[J].水产科技情报, 2011, 38(4):216-218. DOI: 10.3969/j.issn.1001-1994.2011.04.013 [13] [缺项].云南罗平10万尾猪嘴鱼鱼苗放流多依河[J].中国水产, 2017(2): 56. [14] 王晓爱, 潘晓赋, 杨君兴, 等.一种暗色唇鱼精子超低温冷冻保存方法: 201210277522.7[P].2012-08-07. [15] 杨君兴, 潘晓赋, 李再云, 等.一种暗色唇鱼的人工繁殖方法: 201210111579.X[P]. 2013-11-27. [16] 刘兴, 许洪亮, 李光华, 等.一种暗色唇鲮的鱼苗培育方法: 201610837430.8[P]. 2016-09-21. [17] 王晓爱, 杨兴, 陈小勇, 等.4种渗透性抗冻剂对暗色唇鱼精子冷冻保存的影响[J].水生态学杂志, 2012, 33(5):88-93. http://d.old.wanfangdata.com.cn/Periodical/sstxzz201205017 [18] 崔鹏, 徐海根, 吴军, 等.中国脊椎动物红色名录指数评估[J].生物多样性, 2014, 22(5):589-595. http://d.old.wanfangdata.com.cn/Periodical/swdyx201405006 [19] 陈小勇.红水河鱼类名录[J].动物学研究, 2013, 34(4):281-343. [20] 徐丽琼, 安莉, 卢宗民, 等.多依河保护区鱼类资源及调查[J].云南农业, 2017(2):60-63. http://d.old.wanfangdata.com.cn/Periodical/ynny201703028 [21] 陈小勇.云南鱼类名录[J].动物学研究, 2013, 34(4):281-343. http://d.old.wanfangdata.com.cn/Conference/8292453 [22] 李思发, 李晨虹, 李家乐.尼罗罗非鱼品系间形态差异分析[J].动物学报.1998, 44(4):450-457. DOI: 10.3321/j.issn:0001-7302.1998.04.011 [23] 谷伟, 王炳谦, 高会江.虹鳟不同养殖群体形态性状变异的初步研究[J].水产学杂志, 2007, 20(2):12-17. DOI: 10.3969/j.issn.1005-3832.2007.02.003 [24] 许宝红, 王亚楠, 肖调义, 等.4种淡水经济鱼类消化道的组织学比较[J]中国农学通报, 2011, 27(32):47-55. http://d.wanfangdata.com.cn/Periodical/zgnxtb201132010 [25] 罗江波, 戴海平, 龙玲利, 等.光唇鱼消化道的形态结构特征[J].生物学杂志, 2013, 30(6):59-65. http://d.old.wanfangdata.com.cn/Periodical/swxzz201306014 [26] 林浩然.五种不同食性鲤科鱼的消化道[J].中山大学学报(自然科学版), 1962(3):65-78. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=QK000005073346 [27] 毕冰, 孙中武, 毛天强, 等.鲤、鲢、鳙、草鱼消化道结构与食性的研究[J]水产学杂志, 2011, 24(1):26-29. DOI: 10.3969/j.issn.1005-3832.2011.01.005 [28] 许亮清, 姚毅, 熊春贤.鄱阳湖感鱼的形态生物学研究[J]江西农业学报, 2012, 24(10):133-135. DOI: 10.3969/j.issn.1001-8581.2012.10.041 [29] 母丹利, 袁思平, 薛聪顺, 等.马口鱼消化道的形态及组织学结构特征[J].宁波大学学报(理工版), 2016, 29(3):39-44. http://d.old.wanfangdata.com.cn/Periodical/nbdxxb-lg201603008 [30] 许宝红, 王亚楠, 肖调义, 等.4种淡水经济鱼类消化道的组织学比较[J]中国农学通报, 2011, 27(32):47-55. http://d.wanfangdata.com.cn/Periodical/zgnxtb201132010 -
期刊类型引用(5)
1. 王鑫,郑立敏,赵星月,苗淑月,叶倩,张宇,史晓斌,张德咏,陈建斌. 西花蓟马FKBP6蛋白多克隆抗体制备、真核表达及亚细胞定位. 农业生物技术学报. 2024(07): 1606-1613 .  百度学术
百度学术
2. 刘欢,何斐,李川. 魔芋病毒病研究进展. 山西农业科学. 2023(02): 217-224 .  百度学术
百度学术
3. 邱佳,余瑛. 东亚飞蝗DSCAM2多克隆抗体制备. 重庆理工大学学报(自然科学). 2023(02): 350-356 .  百度学术
百度学术
4. 米国全,唐艳领,牛莉莉,马凯,杨凡,史宣杰,赵秀山,王晋华. 危害我国番茄的重要病毒病及防控措施. 中国瓜菜. 2021(10): 8-14 .  百度学术
百度学术
5. 林丹,林文忠,尚鹏祥,林文武,丁新伦,吴祖建,张洁. 木尔坦棉花曲叶病毒编码4个蛋白的抗血清制备. 福建农业学报. 2021(11): 1359-1364 .  本站查看
本站查看
其他类型引用(2)




 下载:
下载: