Effect of Preservation Methods on Retention of Main Quality Compnents in Fresh Tea Leaves
-
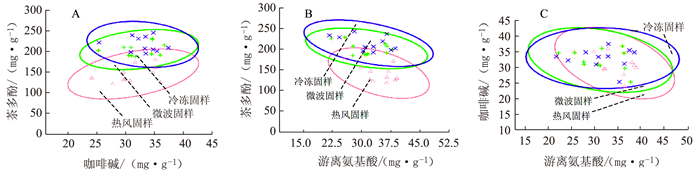
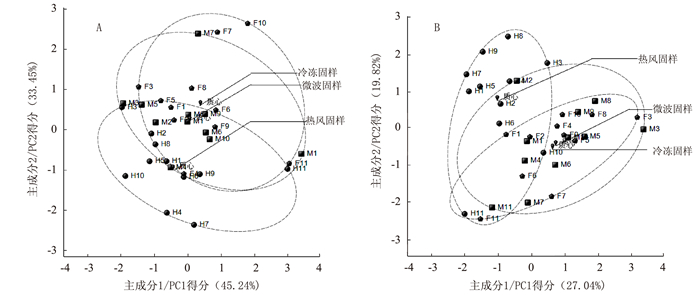
摘要: 为准确反映茶鲜叶生化成分的组成特征,对11个茶树品种鲜叶分别进行冷冻固样、热风固样和微波固样,并通过二维"点集"分布视图和主成分分析,对不同固样方法所获得供试样品的茶多酚总量、游离氨基酸总量、咖啡碱含量、主要儿茶素和游离氨基酸组分进行比较分析。结果表明:热风固样与冷冻固样样品存在较明显的类群区分,且热风固样样品中的茶多酚总量、表没食子儿茶素没食子酸酯、表儿茶素、表儿茶素没食子酸酯、天冬氨酸、精氨酸、丝氨酸、胱氨酸均显著低于冷冻固样;微波固样与冷冻固样无明显的样品类群区分。综合考虑简便性、保真性、节能性等方面,微波固样更适用于茶鲜叶取样制备,其样品生化检测结果可为茶鲜叶质量的化学评价提供参考依据。Abstract: Fresh leaves plucked from tea bushes of 11 varieties were preserved by freezing, hot-air drying or microwave heating to compare the retention of polyphenols, free amino acids and caffeine in the leaves. The two-dimensional point set distribution and principal component analyses were performed to determine the data variances among the samples. The results showed that the contents of polyphenols, EGCG, EC, ECG, aspartate, arginine, serine and cystine were significantly lower in the tea leaves treated by hot-air than by freezing. Either microwaved or frozen leaves could largely retain the original composition. However, being convenient and efficient in handling and for preservation, the microwave method was recommended for the application.
-
Keywords:
- fresh tea leaves /
- freezing /
- hot-air drying /
- microwave heating
-
0. 引言
【研究意义】氟苯尼考(florfenicol,FF)是甲砜霉素和氯霉素的氟化类似物,是抗生素类药物家族中具有广泛抗菌谱的新型半合成成员,对众多革兰氏阳性、阴性菌和支原体等具有显著的抑制效果,且有着抗菌活性强、廉价高效等优点,被广泛用于水产养殖业和畜牧业的疾病治疗中[1]。欧盟规定FF药物在禽蛋中的最高残留限量(Maximum residue limit,MRL)为100 μg·kg−1[2]。禽蛋作为来源最广、蛋白质含量较高的动物性食品,人们对其日常需求量非常大,近年来随着生活水平的提高,鸽蛋和鹌鹑蛋也渐渐走上餐桌,占据禽蛋市场不小的份额,而许多不法养殖者为了提高经济效益,将FF等药物不合理使用,以致FF及其主要代谢产物氟苯尼考胺(florfenicol amine,FFA)过量残留在鸽蛋和鹌鹑蛋中,增加了消费者患再生障碍性贫血和耐药性细菌产生的潜在风险,严重威胁消费者的健康[3-4]。因此建立鸽蛋和鹌鹑蛋中FF和FFA残留的检测方法对于保障消费者身体健康和进出口贸易顺利进行具有重要的实际意义。【前人研究进展】目前,国内外对FF及FFA残留检测的方法主要包括:酶联免疫法(ELISA)[5-6]、液相色谱法(LC)[7-8]、液质联用法(LC-MS/MS)[9-12]和气质联用法(GC-MS/MS)[13-14]等,有的方法[9, 12]只检测FF一种药物,而FFA作为FF的标志性残留物,欧盟规定FF的残留量以其自身和FFA的总量计;虽然液-液提取法不需要复杂的提取设备,仪器成本低,但其操作过程繁琐,耗时费力且误差较大,浪费大量的有机溶剂,同时对实验人员身体健康有一定的损害。加速溶剂萃取(ASE)在高温高压条件下减小了目标物和样品基质之间的相互作用力,实现了提取剂与目标物更好的接触,提高萃取效率,因此ASE法具有快速全自动、回收率高、溶剂使用量小、重现性好、可批量处理样品等优点,故本试验采用ASE提取法进行样品前处理[15]。使用最多的检测方法就是质谱法(MS)[10],MS虽然定性定量准确,灵敏度高,但仪器价格昂贵,检测成本高;在满足检测要求的前提下开发新的、低成本检测方法十分必要。【本研究切入点】综合国内外研究,目前采用加速溶剂萃取结合超高效液相色谱-荧光检测法(ASE/UPLC-FLD)对鸽蛋和鹌鹑蛋中FF和FFA残留同时检测的方法尚未见报道,且我国也尚未建立蛋品中同时检测FF和FFA残留的国家标准检测方法。【拟解决的关键问题】本试验采用ASE法提取样品,再用乙腈饱和的正己烷去脂,以乙腈∶氨水(98∶2,V/V)为提取剂,建立鸽蛋、鹌鹑蛋中FF和FFA残留检测的UPLC-FLD法,为鹌鹑蛋和鸽蛋中FF和FFA残留检测提供新的检测方法、技术手段和科学依据。
1. 材料与方法
1.1 试验材料
1.1.1 试验样品
试验样品为35周龄产蛋家鸽50只(江苏江南鸽业有限公司)和20周龄产蛋鹌鹑30只(兴化市安丰镇鹌鹑养殖有限公司),试验前预饲2周不添加任何药物的全价饲料,每天取蛋放入低温蛋库中,最后将全蛋匀浆后分装保存于−34℃冰箱中备用。
1.1.2 仪器及试剂
Acquity UPLC超高效液相色谱仪(配有荧光检测器,Waters公司);ASE350型加速溶剂萃取仪(Thermo Fisher公司);5810R型高速冷冻离心机(Eppendof公司);离心浓缩仪(LaboGene公司);Mettler Toledo FE20型pH计(梅特勒-托利多仪器有限公司)。
FF标准品(纯度≥99.0%,Dr. Ehrenstorfer GmbH有限公司);FFA标准品(纯度≥99.8%,WITEGA Laboratorien Berlin-Adlershof GmbH有限公司;乙腈、三乙胺均为色谱纯;磷酸二氢钠、磷酸、己烷、氨水、十二烷基硫酸钠等均为分析纯;试验用水为超纯水。
1.2 试验方法
1.2.1 标准溶液的配制
FF标准溶液配制:准确称取FF标准品4.04 mg(因纯度≥99.0%,故实际FF含量为4.00 mg),用乙腈定容至10 mL,配制成400.0 mg·L−1的FF标准溶液。FFA标准溶液配制:准确称取FFA标准品1.01 mg(纯度≥99.8%,故实际FFA含量为1.00 mg),先用1 mL超纯水溶解后用乙腈定容至10 mL,配制成100.0 mg·L−1的FFA标准溶液。
1.2.2 样品的提取与净化
准确称取鸽蛋和鹌鹑蛋空白样品(2.0±0.02)g放入适量硅藻土中,研磨混合均匀后装入萃取池中进行加速溶剂萃取,使用的萃取剂为乙腈∶氨水(98∶2,V/V),萃取压力为1500 psi,80℃下萃取3 min,萃取剂的用量控制在萃取池体积的40%左右,样品间自动冲洗1次,氮气吹扫60 s并静态循环2次。使用离心浓缩仪将收集的萃取液浓缩近干,分别向其中加入1 mL乙腈涡旋震荡溶解残渣,再加入8 mL乙腈饱和的正己烷去脂,再次浓缩至干备用。用2.0 mL流动相将浓缩干后的样品复溶并涡旋1 min,12 100 g转速下离心15 min后过0.22 μm聚偏氟乙烯针式滤器,滤液供UPLC-FLD系统检测。
1.2.3 超高效液相色谱条件
色谱柱为Acquity UPLC® BEH C18 柱(2.1 mm × 100 mm,1.7 μm);流动相A:超纯水(含0.005 mol·L−1NaH2PO4溶液,0.05%的三乙胺和0.003 mol·L−1十二烷基硫酸钠,用85% H3PO4调pH至5.3±0.1);流动相B:乙腈;洗脱方式:流动相A∶B=64∶36等度洗脱;荧光检测器的激发波长与发射波长分别为233 nm和284 nm;流速:0.2 mL·min−1;进样体积:10 μL;柱温:30℃。
1.2.4 标准曲线的绘制
取适量鸽蛋和鹌鹑蛋空白样品按1.2.2的方法处理并添加一定浓度的FF和FFA标准工作液,使得对应鸽蛋和鹌鹑蛋基质中FF的添加质量比为LOQ、20.0、50.0、100.0、200.0、300.0、400.0 μg·kg−1,FFA的添加质量比为LOQ、10.0、20.0、50.0、100.0、200.0、400.0 μg·kg−1,再将各浓度样品通过UPLC-FLD系统检测并绘制出标准曲线。
1.2.5 样品回收率测定
准确称取匀浆好的鸽蛋和鹌鹑蛋空白样品(2.0±0.02)g,与适量硅藻土混合研磨均匀,加入FF和FFA标准工作液使得对应鸽蛋基质中FF的添加质量比为11.2、50.0、100.0、200.0 μg·kg−1,FFA的添加质量比为4.8、50.0、100.0、200.0 μg·kg−1;对应鹌鹑蛋基质中FF的添加质量比为10.6、50.0、100.0、200.0 μg·kg−1,FFA的添加质量比为4.6、50.0、100.0、200.0 μg·kg−1,每个添加水平设置6个平行,搅拌混匀填入萃取池,经萃取净化后供UPLC-FLD检测,最后代入标准曲线中求得浓度,并计算样品回收率。
1.2.6 精密度测定
精密度可用来表示测量方法的再现性,是试验准确性的重要参数之一。在同一天内进行6次重复测定,求出日内RSD;在不同天重复进行试验,求出日间RSD。
1.2.7 检测限和定量限测定
在本试验建立的方法条件下,取空白样品进行添加回收分析试验,每个浓度分析3次,当信噪比值大于等于3(S/N≥3)时所对应的添加浓度即为分析方法的检测限(limit of detection,LOD);当信噪比值大于等于10(S/N≥10)时所对应的添加浓度即为分析方法的定量限(limit of quantitation,LOQ)。
2. 结果与分析
2.1 不同萃取剂提取FF和FFA的回收率
本试验对鸽蛋和鹌鹑蛋样品基质中不同比例氨水氨化的乙腈(99∶1,98∶2,97∶3,96∶4,95∶5)对目标物提取效果进行对比,其结果见表1。表明萃取剂乙腈:氨水(98∶2,V/V)时提取效果最好,两种目标药物回收率均大于92.00%。
表 1 不同萃取剂对氟苯尼考和氟苯尼考胺提取回收率的影响Table 1. FF and FFA recoveries by different solvents(单位:%) 分析物
Analyte基质
Matrix萃取剂乙腈∶氨水 Extraction reagent acetonitrile-ammonia 99∶1 98∶2 97∶3 96∶4 95∶5 氟苯尼考
FF鸽蛋
Pigeon egg92.28±2.41 93.12±1.95 83.82±1.88 76.12±3.01 61.00±2.19 鹌鹑蛋
Quail egg92.73±2.23 94.24±2.47 86.24±2.49 74.48±2.41 68.53±2.48 氟苯尼考胺
FFA鸽蛋
Pigeon egg88.23±2.24 96.32±2.14 86.53±2.70 73.09±2.13 64.82±2.27 鹌鹑蛋
Quail egg86.46±1.79 92.96±1.92 84.65±2.51 76.20±1.92 70.38±1.84 2.2 色谱图
如图1 A-E 所示,在UPLC-FLD检测条件下,目标物FF和FFA在鸽蛋和鹌鹑蛋样品基质中均与杂质分离,峰形较好,出峰时间分别在2.1 min和3.8 min左右,无干扰杂峰。
![]() 图 1 标准品、空白鸽蛋/鹌鹑蛋、空白鸽蛋/鹌鹑蛋样品添加标准品(FF和FFA 50 μg·kg−1)色谱注:A,氟苯尼考和氟苯尼考胺标准品(50.0 μg·kg−1)色谱图;B,空白鸽蛋色谱图;C,加标鸽蛋样品色谱图;D,空白鹌鹑蛋色谱图;E,加标鹌鹑蛋样品色谱图。Figure 1. Chromatograms of standards, pigeon egg/quail egg blank, pigeon egg/quail egg spiked with 50.0 µg·kg−1 FF and FFANote:A=Chromatogram of FF and FFA standards (50.0 µg·kg−1); B=Chromatogram of pigeon egg blank; C=Chromatogram of spiked pigeon egg samples; D=Chromatogram of quail egg blank; E=Chromatogram of spiked quail egg samples.
图 1 标准品、空白鸽蛋/鹌鹑蛋、空白鸽蛋/鹌鹑蛋样品添加标准品(FF和FFA 50 μg·kg−1)色谱注:A,氟苯尼考和氟苯尼考胺标准品(50.0 μg·kg−1)色谱图;B,空白鸽蛋色谱图;C,加标鸽蛋样品色谱图;D,空白鹌鹑蛋色谱图;E,加标鹌鹑蛋样品色谱图。Figure 1. Chromatograms of standards, pigeon egg/quail egg blank, pigeon egg/quail egg spiked with 50.0 µg·kg−1 FF and FFANote:A=Chromatogram of FF and FFA standards (50.0 µg·kg−1); B=Chromatogram of pigeon egg blank; C=Chromatogram of spiked pigeon egg samples; D=Chromatogram of quail egg blank; E=Chromatogram of spiked quail egg samples.2.3 标准曲线、检测限、定量限的确定
如图2和图3可得,在空白鸽蛋样品中,FF和FFA的添加质量比分别在11.2~400.0 μg·kg−1和4.8~400.0 μg·kg−1,其峰面积与质量比呈良好的线性关系,线性回归方程分别为y = 762.75x + 795.56和y = 4 019.2x + 540.28,相关系数分别为0.999 2和0.999 8;在空白鹌鹑蛋样品中,FF和FFA的添加质量比分别在10.6~400.0 μg·kg−1和4.6~400.0 μg·kg−1,其峰面积与质量比呈良好的线性关系,线性回归方程分别为y = 753.91x−163.29和y = 4 824.5x−184.02,对应相关系数分别为0.999 9和0.999 4。在鸽蛋中,FF的LOD为4.8 μg·kg−1,LOQ为11.2 μg·kg−1;FFA的LOD为1.9 μg·kg−1,LOQ为4.8 μg·kg−1;鹌鹑蛋中FF的LOD为4.7 μg·kg−1,LOQ为10.6 μg·kg−1;FFA的LOD为1.8 μg·kg−1,LOQ为4.6 μg·kg−1。结果表明,此方法灵敏度高,完全满足鹌鹑蛋和鸽蛋中FF和FFA残留检测的要求,满足欧盟2002/675/EC[2]决议关于多种药物残留检测中方法论证参数的要求。
2.4 空白基质添加FF和FFA的回收率和精密度
空白鸽蛋和鹌鹑蛋中FF和FFA的加标回收率及精密度见表2和表3。在鸽蛋样品中,当FF和FFA添加质量比分别为11.2、50.0、100.0、200.0 μg·kg−1和4.8、50.0、100.0、200.0 μg·kg−1时,其添加的回收率分别为85.33%~98.04%和84.69%~96.82%;在鹌鹑蛋样品中,当FF和FFA添加质量比分别为10.6、50.0、100.0、200.0 μg·kg−1和4.6、50.0、100.0、200.0 μg·kg−1时,其添加的回收率分别为87.26%~96.95%和86.32%~96.84%。说明本试验运用的ASE技术对样品进行前处理效果较好,所测得的样品回收率在84.69%~98.04%,添加质量比为LOQ水平时,回收率在84.69%~87.26%,RSD在3.7%以下,说明本试验所采用的方法自动化程度高、萃取效率高、重复性好。
表 2 空白鸽蛋中FF和FFA添加回收率和精密度(n=6)Table 2. Recovery and precision of determinations on pigeon egg spiked with FF and FFA (n=6)分析物
Analyte添加质量比
Adding level/(μg·kg−1)回收率
Recovery/%相对标准偏差
RSD/%日内相对标准偏差
Intra-day RSD/%日间相对标准偏差
Inter-day RSD/%氟苯尼考
FF11.2a 85.33±2.39 2.80 2.96 3.15 50 96.42±2.10 2.18 3.84 4.52 100b 98.04±3.63 3.70 3.25 4.97 200 97.93±2.56 2.61 2.94 3.31 氟苯尼考胺 FFA 4.8a 84.69±1.84 2.17 3.42 4.43 50 94.08±2.43 2.58 2.70 3.06 100.0b 95.14±2.90 3.05 3.86 5.18 200 96.82±1.73 1.79 2.21 3.60 注:a.定量限;b. 最高残留限量,表3同。
Note:a=LOQ; b=Maximum residue limit. The same for Table 3.表 3 空白鹌鹑蛋中FF和FFA添加回收率和精密度(n=6)Table 3. Recovery and precision of determinations on quail egg spiked with FF and FFA (n=6)分析物
Analyte添加质量比
Adding level/(μg·kg−1)回收率
Recovery/%相对标准偏差
RSD/%日内相对标准偏差
Intra-day RSD/%日间相对标准偏差
Inter-day RSD/%氟苯尼考
FF10.6a 87.26±3.23 3.70 4.98 5.33 50 95.73±2.14 2.24 2.65 3.58 100b 95.36±2.91 3.05 3.73 4.49 200 96.95±2.42 2.50 2.91 3.52 氟苯尼考胺
FFA4.6a 86.32±2.49 2.88 3.60 3.92 50 96.73±2.75 2.84 4.13 5.43 100.0b 95.62±3.21 3.36 3.54 5.62 200 96.84±3.36 3.47 4.86 5.84 2.5 标准溶液的稳定性考察
标准溶液的稳定性考察不仅可以节省开支,节约时间人力,大大缩减试验成本,同时对试验结果的准确性也十分重要。本试验对FF和FFA标准溶液进行稳定性考察试验,结果表明标准溶液在−70℃环境下避光保存3个月,4℃环境下保存1个月,或室温下保存24 h,其稳定性均较好。
3. 讨 论
3.1 样品前处理方法的优化
在已报道文献中,对于氯霉素类药物的提取多采用液-液提取的方法,使用的萃取剂多为乙腈、乙酸乙酯或两者的混合物[16-17]。采用自动提取设备提取基质中的报道很少,而使用加速溶剂萃取仪同时萃取禽蛋中的FF和FFA的方法未见报道。样品前处理效果直接关系到后续检测结果的好坏,液-液萃取繁琐的手动操作增加了样品污染和目标物丢失等风险,而ASE提取法样品回收率高、高效快速全自动,重复性好,所以本试验采用ASE提取法减少手动操作的误差,提高目标物回收率。另外,萃取剂的选择对目标物的提取效率的影响也很大,乙腈的去蛋白效果较好,而禽蛋中最主要的干扰物质就是蛋白质,为了获得更高的提取效率,最终选择氨水氨化的乙腈作为萃取剂。因为FFA带有氨基,是弱碱性化合物,根据相似相融的提取原理,对比不同比例氨水氨化的乙腈的提取效果,最终选择2%的氨水氨化的乙腈,效果最好,所有目标物的回收率均在90.00%以上。
3.2 色谱条件的优化
流动相的组成、色谱柱的类型等因素很大程度上影响目标物的分离和峰形的好坏。在已有报道中,Wang[18]、Moretti[19]等研究中采用C18色谱柱,均获得了较高的分离度,故本试验选用ACQUITY UPLC® BEH C18柱作分析柱。但是由于FFA中含有氨基,其属于弱碱性物质,在C18柱上基本不保留,随死体积一起被洗脱出来。常采取的解决办法就是在流动相体系中加入甲酸铵或乙酸铵。Xie等以乙腈∶NaH2PO4溶液(0.01 mol·L−1,含0.005 mol·L−1十二烷基硫酸钠和0.10%三乙胺,用85%H3PO4调pH至4.5)=32∶68(V/V)为流动相,能够很好地分离鸡蛋中甲砜霉素、FF和FFA。本试验在先前的研究基础上,针对离子对试剂(十二烷基硫酸钠)、缓冲体系(磷酸盐-磷酸)、三乙胺的用量和pH进行进一步的优化。试验考察了1、3、5、10 mmol·L−1的十二烷基硫酸钠的影响,发现随其用量的增加,FFA出峰时间后延,3 mmol·L−1的用量即可保证FFA出峰时间在前面;比较了0、3、5、10、20 mmol·L−1的NaH2PO4的影响,发现随其用量的增加,FFA出峰时间略有提前,但盐的使用对仪器寿命有一定影响,且易造成色谱柱堵塞,在兼顾FFA出峰和维护仪器的条件下,选用5 mmol·L−1的用量;考察了不同用量(0.01%、0.03%、0.05%和0.1%)的三乙胺的影响,发现0.01%的用量可改善峰拖尾的现象,但随其用量的增加FFA的出峰时间提前,综合考虑最终确定三乙胺用量为0.05%;pH对于出峰时间也有一定影响。试验发现FFA的响应值随着pH的降低逐渐增强、出峰时间逐渐后延,当pH为5.4时,FFA的响应值达到最高,再降低pH对其响应值影响不大。但出峰时间太靠后会延长检测时间,降低检测效率,因此,最终确定pH为5.3±0.1。为使目标物与杂质分开,调节流动相比例,当流动相比例为64∶36时,目标物与杂质分离效果好且峰形良好。因此综合考虑选定流动相条件为:NaH2PO4溶液(5 mmol·L−1,含3 mmol·L−1十二烷基硫酸钠、0.05%的三乙胺,调pH为5.3±0.1)∶乙腈=64∶36(V/V)。此外,本试验采用的UPLC法具有高分离度和高速度等优点,在提高柱效的同时也提高了系统的灵敏度,目标物均在5 min内被检测到,大大缩短了检测时间,提高了检测效率,符合实际生产中检测应用的要求。
3.3 基质效应的评价
在试验过程中,基质效应只能通过各种方法降低其影响,但不可消除。本研究采用加速溶剂萃取法降低前处理过程中内源性物质的影响,同时优化色谱分析条件,适当地延长待测组分的保留时间,以降低基质效应的影响。此外,本试验采用10 μL的较小进样量和0.2 mL•min−1的较低流速,既保证灵敏度又能降低基质效应对检测结果的影响。
4. 结 论
本研究首次建立并优化了超高效液相色谱-荧光检测法检测鸽蛋和鹌鹑蛋中FF、FFA残留的分析方法,并将ASE法提取目标物与之结合,优化萃取条件和色谱条件以提高回收率及试验的准确性。在本试验的方法及条件下,鸽蛋及鹌鹑蛋中FF和FFA的相对标准偏差均小于3.7%,回收率均在85%以上。该方法快速、方便、自动化程度高,且定量准确回收率高,满足欧盟兽药残留检测的要求,对于保障消费者健康和打破贸易壁垒具有重要的实际意义。
-
表 1 3种固样方法茶叶样品
Table 1 Codes for samples of 3 preservation methods
茶树品种 冷冻固样 热风固样 微波固样 茗科1号 F1 H1 M1 黄观音 F2 H2 M2 金凤凰 F3 H3 M3 矮脚乌龙 F4 H4 M4 北斗 F5 H5 M5 铁观音 F6 H6 M6 紫牡丹 F7 H7 M7 白鸡冠 F8 H8 M8 奇丹 F9 H9 M9 白芽奇兰 F10 H10 M10 紫鹃 F11 H11 M11 表 2 不同固样方法样品茶多酚总量、游离氨基酸总量、咖啡碱含量
Table 2 Effect of preservation methods on contents of polyphenols, free amino acids and caffeine in tea leaves
[单位/(mg·g-1)] 固样方式 茶多酚 游离氨基酸 咖啡碱 冷冻固样 216.69±18.11Aa 31.75±5.39 32.98±3.15 热风固样 144.99±19.74Bb 34.38±4.21 31.35±3.7 微波固样 204.13±15.77Aa 32.36±3.35 31.25±5.08 注:同列数据后不同大、小写字母表示差异达极显著(P < 0.01)或显著(P < 0.05)水平,无字母标记表示差异不显著,下表同。 表 3 供试样品的主要儿茶素和游离氨基酸组分含量
Table 3 Contents of main catechins and free amino acids in tea samples
[单位/(mg·g-1)] 处理 EGC EGCG EC ECG Thea Asp His Arg Ala Glu Ser Thr Cys Lys 冷冻固样 38.27±9.94Aa 114.84±20.75a 9.67±2.51Aa 33.09±7.99Aa 11.60±3.91 Aa 1.81±0.68a 2.21±0.82 Aa 4.76±2.42Aa 0.09±0.04Bb 1.12±0.75 Aa 0.55±0.12a 0.30±0.05b 1.17±0.25Aa 0.01±0.01b 热风固样 40.29±8.94 Aa 90.90±22.53b 6.44±2.6Bb 24.91±5.89Bb 11.65±2.77 Aa 1.14±0.66b 2.56±0.84 Aa 1.63±1.55Bb 0.31±0.20Aa 0.99±0.67 Aa 0.36±0.23b 0.32±0.04ab 0.03±0.08Bb 0.04±0.03a 微波固样 35.47±9.06 Aa 105.30±17.30ab 9.16±2.92ABa 29.88±6.63ABab 10.84±4.06 Aa 2.00±0.87a 2.10±0.57 Aa 3.49±2.05ABa 0.07±0.08Bb 0.86±0.45 Aa 0.51±0.10a 0.35±0.03a 0.14±0.13Bb 0.01±0.02ab -
[1] 中国农业科学院茶叶研究所.茶树生理及茶叶生化实验手册[M].北京:农业出版社, 1983:20-49. [2] 杨如兴.一芽二叶蒸青固样时间对茶叶主要组分含量的影响[J].福建茶叶, 2002, 24(4):8-9. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=fjcy200204004 [3] 周国兰.蒸青固样方式对茶叶主要生化成分的影响[J].贵州农业科学, 2009, 39(7):199-200. http://www.cqvip.com/QK/91510X/200901/29727686.html [4] 李立祥, 童梅英.固样方法对茶叶化学成分及品质的影响[J].安徽农业大学学报, 2000, 27(4):394-399. http://www.cnki.com.cn/Article/CJFDTOTAL-NYJX201304030.htm [5] 胡云铃. 茶鲜叶固定方法研究及不同杀青方式对绿茶品质形成的影响[D]. 长沙: 湖南农业大学, 2009. [6] 陈金华, 黄建安, 宁静.茶叶微波固样技术研究[J].茶叶通讯, 2006, 33(1):14-18. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=cytx200601010 [7] 靖翠翠, 杨秀芳, 谭蓉, 等.微波制样对茶叶内质成分的影响[J].食品安全质量检测学报, 2015, 6(4):1265-1270. http://www.cqvip.com/QK/71822X/201504/83806574504849534852485152.html [8] 林平, 朱海翔, 李远志, 等.热风和微波预脱水对胡萝卜真空冷冻干燥效果的影响[J].现代食品科技, 2010, 26(4):380-382. http://www.cnki.com.cn/Article/CJFDTotal-SPKX201609020.htm [9] AYDIN E S, YUCEL O, SADIKOGLU H.Modelling and simulation of a moving interface problem:freeze drying of black tea extract[J].Heat & Mass Transfer, 2017, 53(6):1-12.
[10] 龚志华, 肖文军, 蔡利娅, 等.茶叶固样方法研究[J].湖南农业大学学报(自然科学版), 2006, 32(1):45-48. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=shanxzyxyxb200304016 [11] 杨伟丽, 揭国良.固样方法对茶鲜叶化学成分的影响[J].广东茶业, 2004, 4(1):22-23. http://mall.cnki.net/magazine/Article/GDZC200401009.htm [12] 王丽丽, 陈键, 宋振硕, 等.茶叶中没食子酸、儿茶素类和生物碱的HPLC检测方法研究[J].福建农业学报, 2014, 29(10):987-994. DOI: 10.3969/j.issn.1008-0384.2014.10.011 [13] 宋振硕, 王丽丽, 陈键, 等.茶鲜叶萎凋过程中游离氨基酸的动态变化规律[J].茶叶学报, 2015, 56(4):206-213. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=cykxjs201504003 [14] 叶乃兴.茶叶品质性状的构成与评价[J].中国茶叶, 2010, 32(8):10-11. http://www.cnki.com.cn/Article/CJFDTOTAL-XBLY200105000.htm [15] BALENTINE D A, WISEMAN S A, BOUWENS L C.The chemistry of tea flavonoids[J].Critical Reviews in Food Science & Nutrition, 1997, 37(8):693-704.
[16] HARA Y.Tea catechins and their applications as supplements and pharmaceutics[J].Pharmacological Research the Official Journal of the Italian Pharmacological Society, 2011, 64(2):100. DOI: 10.1016/j.phrs.2011.03.018
[17] 李金辉. 不同处理对白茶游离氨基酸及主要生化成分含量影响的研究[D]. 福州: 福建农林大学, 2010. [18] 宛晓春, 黄继轸, 沈生荣.茶叶生物化学[M].北京:中国农业出版社, 2007:9-39. [19] 张正竹.茶叶生物化学实验教程[M].北京:中国农业出版社, 2009:20. [20] 邓志汇. 液氮提取茶鲜叶的茶多酚及其降血脂研究[D]. 广州: 华南理工大学, 2012. -
期刊类型引用(7)
1. 张倩勉,黄燕红,黄海霞. 基质匹配外标法优化国家标准检测鸡蛋酰胺醇类残留. 现代化工. 2025(05): 262-266 .  百度学术
百度学术
2. 刘迪,王会霞,黄坤,罗彤,曾妮,郭晓希,石梦玲,徐芬,柳迪. 同位素稀释-液相色谱-串联质谱法测定肉制品中氟苯尼考及代谢物氟苯尼考胺残留. 中南农业科技. 2024(07): 58-62 .  百度学术
百度学术
3. 罗嘉儿,欧佳灵. QuEChERS-高效液相色谱串联质谱法测定猪肉中氟苯尼考残留量. 食品安全导刊. 2024(31): 84-87 .  百度学术
百度学术
4. 管凡荀,高鹏飞,汤亚云,刘书余,朱雅丽,谢恺舟. 基于液相色谱和液质联用法的动物源性食品中氟喹诺酮类与酰胺醇类药物残留检测研究进展. 食品工业科技. 2023(06): 448-458 .  百度学术
百度学术
5. 乔青青,郝莉花,巩凡,刘燕,赵芳. 气相色谱质谱法检测鸡蛋中氟苯尼考及氟苯尼考胺. 食品工业. 2021(01): 324-327 .  百度学术
百度学术
6. 张萍,何婷,王颖,胡克特,顾丁,陈荣祥. 加速溶剂萃取-超高效液相色谱-串联质谱法测定大枣中3种五环三萜酸. 食品与药品. 2021(01): 17-22 .  百度学术
百度学术
7. 刘莉丽,梁少东. 2019—2020年北海市禽蛋中6种兽药残留检测结果分析. 食品安全导刊. 2021(19): 86-88 .  百度学术
百度学术
其他类型引用(2)




 下载:
下载: