Nutrient Losses of Tremella fuciformis During Water-soaking
-
摘要: 刚采摘的银耳在烘干前通常需要经过清水浸泡,往往造成银耳营养成分及重量的流失。本研究通过设置不同浸泡时间,检测银耳的干物质以及营养物质的流失情况,以期获得最适的浸泡时间。结果显示:银耳干物质在浸泡1 h后流失较为严重;多糖在浸泡1.5 h后流失较为严重;粗蛋白在浸泡2 h后流失较为严重;在浸泡50 min的时候发现总三萜流失;粗脂肪在浸泡1.5 h时后流失就较为严重。因此,在银耳烘干前的浸泡工艺中,建议将浸泡时间控制在1.0~1.5 h,能较大程度地减少银耳浸泡过程中的营养流失,且保持鲜艳的颜色及舒展的朵型,从而为在浸泡过程中减少营养物质损失提供一定的理论依据。Abstract: Prior to dehydration, freshly harvested Tremella fuciformis are generally soaked in water. The procedure causes losses of nutritional and solid contents in the edible white fungi. To reduce the losses and determine the optimal soaking time, an experiment was conducted. It was found that the occurrence of the greatest loss of a substance(s) varied by the length of soaking time. Most of the dry matters was leached out after soaking for 1 h; the polysaccharides, 1.5 h; the crude protein, 2 h; the total triterpenoids, 50 min; and, the crude fat, 1.5 h. Taking all factors into consideration, 1 h to 1.5 h was recommended for the operation, as it would minimize the nutrient loss, and at the same time, render a bright color and a flowery appearance of the fungi ready for subsequent dehydration.
-
Keywords:
- Tremella /
- polysaccharide /
- crude protein /
- total triterpenes /
- crude fat
-
银耳Tremella fuciformis Berk.,又名白木耳、雪耳,在分类学上隶属于真菌门Eumyeota、担子菌纲Basidiomyeetes、异隔担子菌亚纲Heterobasidiae、银耳目Tremellales、银耳科Tremellaeeae、银耳属Tremella[1-2],有“菌中之冠”的美称[3]。银耳味甘、淡、性平、无毒,含有丰富的碳水化合物、蛋白质、维生素以及微量元素等营养成分[4]。银耳不但有补脾开胃的功效,能起到很好的滋阴润肺以及清肠的作用,而且能提高人体的免疫力和肿瘤患者对化疗的耐受能力[5-9]。
我国是银耳的主要生产国和出口国,销售现阶段还是以干制品为主[10],在世界银耳生产领域处于一枝独秀的重要地位。但是新采摘的银耳通常需要经过清水浸泡,再进行烘干,过程中会造成不同程度的营养物质损失,从而造成菇农的经济损失[11-12]。迄今未见关于银耳干燥前浸泡过程中银耳损失情况的研究。本研究通过设置不同的浸泡时间,探究银耳在浸泡过程中干物质流失情况以及对流失成分进行分析,以期提出更加合理的银耳浸泡时间,尽可能地减少银耳浸泡过程中的营养流失,为在银耳干品制备过程中降低损失提供一定的理论依据。
1. 材料与方法
1.1 材料与试剂
银耳:福建省祥云生物科技发展有限公司;牛血清蛋白:翊圣生物;熊果酸:北京荣宝科技有限公司;香草醛:西格玛奥德里奇贸易有限公司;浓硫酸:兰溪旭日化工有限公司;葡萄糖、无水乙醇(分析纯):国药集团化学试剂有限公司。
1.2 主要仪器
紫外可见分光光度计(UV-1601):北京瑞利分析仪器公司;自动凯氏定氮仪(ATN-1100):上海洪纪仪器设备有限公司。
1.3 试验方法
1.3.1 浸泡时间对银耳干物质流失率的影响
取新鲜银耳40朵均分成4组,分别进行未经浸泡、浸泡1 min、浸泡1 h和浸泡2 h处理,再烘干,由此计算出每组银耳干物质流失率。
X/%=[1−M×M3M1×M2]×100% 式中:X表示流失率(%);M表示未经过浸泡组的银耳烘干前总重量(g);M1表示未经过浸泡组的银耳烘干后的总重量(g);M2表示经过浸泡的银耳烘干前总重量(g);M3表示经过浸泡的银耳烘干后的总重量(g)。
1.3.2 银耳浸泡液中不同成分含量的测定
取5朵形状相似、重量相近的新鲜银耳,将每朵分成3块,每块称重后分别随机放入烧杯中,按照料液比1:10的比例加入蒸馏水。设置银耳浸泡时间为:5、10、15、25、30、40、45、50、60、90、120 min,浸泡相应时间后得上清液,抽滤,样液备用。每个试验重复3次。
(1) 多糖测定:采用苯酚-硫酸法,绘制标准曲线[13]。称取葡萄糖标准品10 g于烧杯中,加蒸馏水溶解后定溶于100 mL容量瓶中,得到葡萄糖标准液100 μg·mL-1。吸取葡萄糖标准溶液0、0.2、0.4、0.6、0.8、1.0 mL,置于带塞试管中,补充蒸馏水到最终体积为2 mL,振荡摇匀,分别加入配制好的0.06 g·mL-1苯酚溶液1 mL,摇匀,迅速滴加浓硫酸5 mL,摇匀静止30 min,于490 nm波长处测定吸光值。以葡萄糖含量为横坐标,吸光值为纵坐标,绘制标准曲线,得线性回归方程y=0.076x-0.0542,R2=0.9987。银耳多糖按照上述方法测定吸光度,计算多糖含量。
X/(mg⋅g−1)=m⋅V1⋅V3⋅V5M⋅V2⋅V4⋅V6 式中:X表示银耳中多糖的含量(mg·g-1);m表示从标准曲线中查得的多糖的质量(mg);M表示样品的质量(g);V1表示样品提取液的体积(mL);V2表示沉淀粗多糖所用样品提取液的体积(mL);V3表示粗多糖总体积(mL);V4表示沉淀葡萄糖所用粗多糖溶液的体积(mL);V5表示样品测定液的体积(mL);V6表示测定样品测定液的体积(mL)。
(2) 粗蛋白的测定:采用考马斯亮蓝法进行蛋白质含量的测定[14]。称取10 mg牛血清蛋白标准品,溶解定容到容量瓶中,作为标准液备用。吸取0、0.1、0.2、0.3、0.4、0.5、0.6 mL标准溶液于7支10 mL干燥试管中,分别加入蒸馏水至1 mL,再加入显色剂5 mL,摇匀,室温静置5 min后,以空白溶液为参比对照,在595 nm波长下测定吸光度。以标准品的含量(mg)为横坐标,吸光度为纵坐标绘制标准曲线,求得回归方程为y=0.063x+0.0497,R2=0.9980。提取液中蛋白质含量由回归方程计算可得。
X/(mg⋅g−1)=m×V′M×V′ 式中:X表示提取液中蛋白质的含量(mg·g-1);m表示查得的蛋白质(mg);M表示试样质量(g);V表示提取液总体积(mL);V′表示测定时提取液体积(mL)。
(3) 总三萜的测定:取100 mg熊果酸标准品用甲醇溶液定容至500 mL。吸取熊果酸标准品溶液0、0.1、0.2、0.3、0.4、0.5 mL到6根具塞试管中,分别加入甲醇补充至0.5 mL。60℃水浴蒸干后,分别加入0.4 mL的5%香草醛-冰醋酸(现配现用)和1 mL的高氯酸,摇匀后,60℃水浴15 min。待冷却至室温,再加入5 mL的冰醋酸,摇匀后经室温静置0.5 h,在波长为546 nm的条件下进行吸光度检测[15]。以熊果酸含量为横坐标,吸光值为纵坐标,得到线性回归方程为y=1.783x+0.0489,R2=0.9935。通过标准曲线算出各样品中三萜的含量。
X/(mg⋅g−1)=A1×V1m×V2×1000 式中:X表示样品中三萜的含量(mg·g-1);A1表示样品测定中比色相当于熊果酸的量(μg);V1表示样品测定液体积(mL);m表示样品质量(g);V2表示测定用样品测定液的体积(mL)。
(4) 粗脂肪的测定:称取10 g液体样品置于50 mL大试管中,加入10 mL盐酸溶液。而后,将加入样品的试管置于70℃水浴锅中,每隔10 min,搅拌1次,直到试管中的试样消化完全为止。取出消化完全的试管,加入10 mL乙醇溶液,充分混合。冷却后将试管中的混合物倒入100 mL具塞试管中,用25 mL乙醚分次清洗试管,将清洗液一起倒入具塞试管,振摇1 min,打开试管塞,释放管内气体,复塞,静置12 min后打开试管塞,用石油醚-乙醚的等量混合液冲洗试管塞以及试管口附着的脂肪。再静置15 min,待上层液体清晰后,吸取上清液到干燥并称量的锥形瓶中,置于水浴锅上蒸干,放在(100±5)℃的烘干箱中干燥2 h,直至烘干至恒量[16]。
X/(mg⋅g−1)=m1−m0m 式中:X表示样品中三萜的含量(mg·g-1);m1表示锥形瓶和粗脂肪的质量(mg);m0表示锥形瓶的质量(mg);m表示样品的质量(g)。
2. 结果与分析
2.1 干物质流失分析
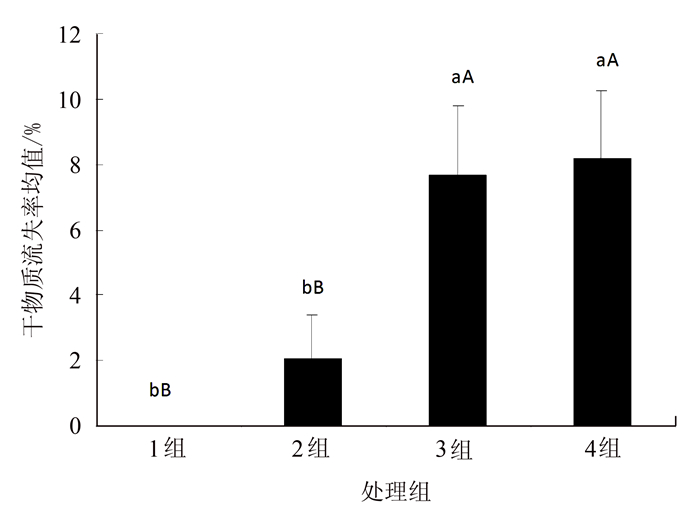
不同浸泡时间下,各组银耳的干物质流失率有所不同。由图 1可知,未经浸泡和浸泡1 min的银耳干物质流失率分别为0和2.05%,两者不存在显著性差异(P>0.05),而浸泡1 h和浸泡2 h的干物质流失率分别为7.68%和8.18%,两者之间也不存在显著性差异(P>0.05)。但浸泡1 h和浸泡2 h对于未经浸泡和浸泡1 min之间都存在极显著差异(P < 0.01)。说明,在浸泡1 h后,银耳的干物质流失较为严重。
2.2 银耳烘干前后的表观比较
银耳经过不同浸泡时间处理后,烘干后的银耳表观比较见图 2。从图中可以看出,银耳在烘干前后的颜色发生了较为明显的变化。烘干前,银耳的颜色大致为浅黄色,而烘干后,浅黄色变为金黄色。其中,未经浸泡的银耳烘干后的颜色比经过浸泡的颜色深,出现焦黄的颜色,未经浸泡的银耳烘干后的颜色鲜艳。同时未经浸泡的银耳烘干后,银耳子实体耳片较为减缩,整朵银耳呈现皱缩焦黄的状态。而经过浸泡的银耳烘干后,子实体耳片相对更加的展开,银耳朵型相对更大,外观更为美观。且从图 2可以看出来,在浸泡1 h以后(包括1 h),银耳的外观相对于其他两组更美观。
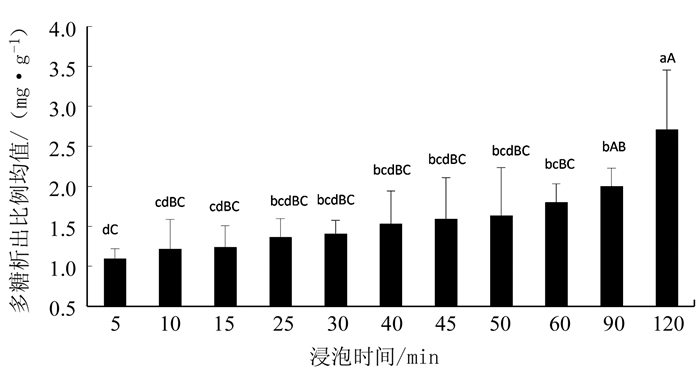
2.3 不同浸泡时间对银耳浸出液中多糖的影响
银耳经过不同浸泡时间处理后,银耳多糖的析出情况见图 3。随着浸泡时间的增加,多糖的析出量也随之增加。浸泡2 h的银耳多糖析出率最高,达到(2.7128±0.7427)mg·g-1,而浸泡5 min的银耳多糖析出率最低,只有(1.0926±0.1270)mg·g-1。其中,浸泡2 h的多糖析出量与浸泡时间≤1 h各组之间均存在极显著差异(P < 0.01),与浸泡1.5 h之间存在显著差异(P < 0.05)。而浸泡1.5 h与浸泡5 min的存在极显著差异(P < 0.01),与浸泡时间≤1h各组(除去浸泡5 min组)之间不存在显著差异(P>0.05)。且在浸泡1.5 h后,多糖的析出量出现了明显的增加,可见以浸泡时间1.5 h为分界线,浸泡时间 < 1.5 h时,多糖的析出呈现增加趋势,但增长趋势不明显,而当浸泡时间>1.5 h,多糖的析出呈现了明显的增长趋势,损失现象较为严重。
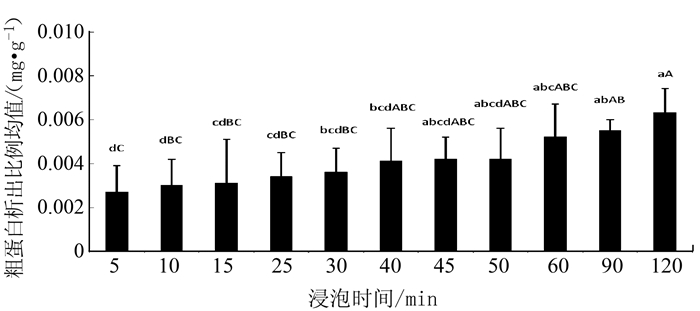
2.4 不同浸泡时间对银耳浸出液中粗蛋白的影响
银耳经过不同浸泡时间处理后,粗蛋白的析出情况见图 4。随着浸泡时间的增加,粗蛋白的析出量也随之增加。经浸泡2 h的银耳粗蛋白析出率最高,达到(0.0063±0.0011)mg·g-1,而浸泡5 min的析出率最低,达到(0.0027±0.0012)mg·g-1。其中,浸泡时间为0.5~2.0 h不存在极显著差异(P >0.05),浸泡2 h与浸泡时间≤30 min各组之间均存在极显著差异(P < 0.01)。在浸泡2 h后,粗蛋白的析出相对于30 min之前已有了明显的增加,流失较为严重。
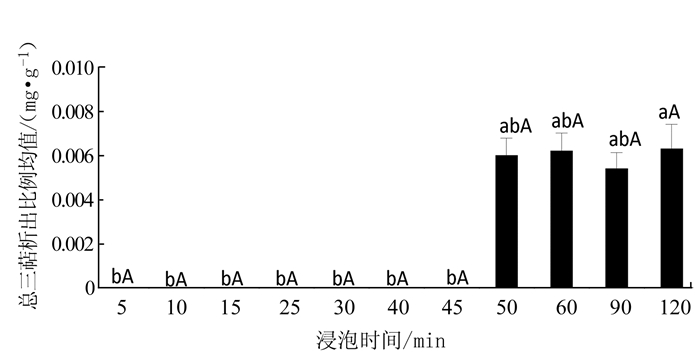
2.5 不同浸泡时间对银耳浸出液中总三萜的影响
不同浸泡时间下每克银耳的三萜析出情况见图 5,在浸泡时间5~45 min,未检测到三萜析出,可能是仪器的限量。在浸泡50 min后,出现三萜的析出,但浸泡50~120 min的三萜析出波动不大,趋于稳定。表明,在银耳的浸泡过程中,在浸泡50 min后会出现三萜的析出,且随着浸泡时间的增加,三萜的析出量几乎趋于稳定。不同浸泡时间下银耳的三萜析出值均未超过0.01 mg·g-1。
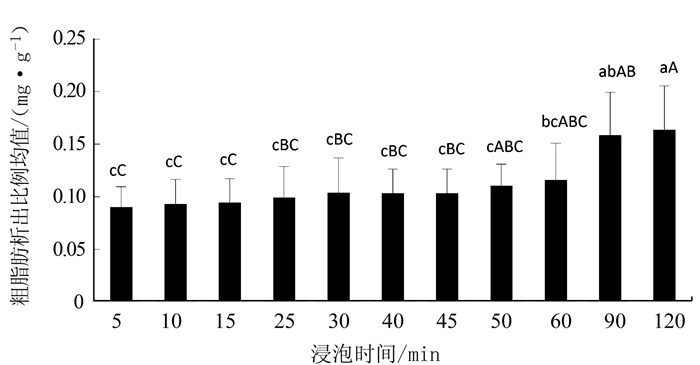
2.6 不同浸泡时间对银耳浸出液中粗脂肪的影响
不同浸泡时间下每克银耳的粗脂肪析出情况见图 6。随着浸泡时间的增加,粗脂肪的析出量也随之增加。经浸泡2 h的银耳粗脂肪析出率最高,达到(0.1632±0.0421)mg·g-1,而浸泡5 min的析出率最低,只有(0.0896±0.0196)mg·g-1。其中,浸泡时间≤1 h的各组间,粗脂肪的析出比例之间不存在显著差异(P>0.05),浸泡1.5 h与浸泡时间 < 1 h的各组间均存在显著性差异(P < 0.05),而浸泡1.5 h和浸泡2 h不存在显著差异(P>0.05)。可见,银耳粗脂肪在浸泡1.5 h后已开始产生严重流失。
3. 讨论与结论
银耳采摘后,经浸泡、漂洗再进行烘干,浸泡的主要目的是洗去杂质,并让银耳耳片舒展,但是对于浸泡时间、浸泡过程中造成的哪些成分的流失均未曾明晰。本研究对经浸泡处理的银耳干物质流失率进行分析,发现浸泡1 h及以后干物质流失较严重。经浸泡后的银耳烘干后,菇朵色泽、大小以及子实体的展开程度等较未经浸泡的银耳更为美观,且经浸泡1 h的银耳烘干后的外形保持的最好。
对银耳浸泡液过程中不同营养成分的测定分析可知,随着浸泡时间的增加,银耳多糖、粗蛋白、总三萜以及粗脂肪均产生了不同程度的流失。浸泡2 h,多糖、粗蛋白、总三萜以及粗脂肪的流失都达到了最大值,分别为(2.7128±0.7427)、(0.0063±0.0011)、(0.0063±0.011)、(0.1632±0.0421)mg·g-1。并且多糖流失在浸泡1.5 h后较为严重;粗蛋白的流失在浸泡2 h时便较为严重;而总三萜流失约在浸泡50 min的时候发生;粗脂肪流失在浸泡1.5 h时就较为严重。综上所述,在烘干前的银耳的浸泡工艺中,将浸泡时间控制在1.0~1.5 h,能最大程度减少银耳浸泡过程中的营养流失,保持较好外观。从浸泡液成分来看,银耳流失的主要成分为多糖,这从理论上解释了银耳浸泡前后的黏性差异。
-
-
[1] WEI T, GAO Z L, ZHANG J. Effects of polysaccharides extracted from Tremella aurantialba mycelium on diabetic mice[J]. Medicinal Plant, 2012, 3(7):21-23. https://www.jstage.jst.go.jp/article/eiyogakuzashi1941/44/6/44_6_307/_article/cited-by
[2] YANG L C, GAO Q S, ZHANG Y H, et al. Tremella-like molybdenum dioxide consisting of nanosheets as an anode material for lithium ion battery[J]. Electrochemistry communications, 2008, 10(1):118-122. DOI: 10.1016/j.elecom.2007.11.009
[3] 贺元川, 陈仕江, 张德利, 等.银耳育种研究进展综述[J].食药用菌, 2013, 32(3):154-155. http://www.oalib.com/paper/5078155 [4] 耿直.浅谈食药用菌的利用价值及前景——以银耳药用食物为例[J].管理观察, 2013, 33(8):103-104. http://www.doc88.com/p-7993700154015.html [5] 杨萍, 张震.银耳的功能性及发展前景[J].食品研究与开发, 2009, 30(7):179-180. http://www.docin.com/p-939478551.html [6] 杨武干, 吴刚, 李彦生.银耳生物学特性及袋料栽培新技术[J].农村科技, 2016, 32(11):61-63. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=nckj201611036&dbname=CJFD&dbcode=CJFQ [7] 张莉, 常明昌, 孟俊龙, 等.工厂化栽培银耳配方筛选[J].山西农业科学, 2016, 44(2):190-192, 203. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=sxlx201602018&dbname=CJFD&dbcode=CJFQ [8] 颜军, 郭晓强, 邬晓勇, 等.银耳多糖的提取及其清除自由基作用[J].成都大学学报:自然科学版, 2006, 25(1):35-38. http://www.docin.com/p-525239412.html [9] 徐占升, 邹翠莲.古田银耳成功上市我省品牌农产品受青睐[J].福建农业, 2014, (3):60-61. http://jz.docin.com/p-653021187.html [10] 吴振, 杨勇, 谭红军, 等.银耳干燥技术研究进展[J].中国食用菌, 2013, 32(2):1-3. http://www.cnki.com.cn/Article/CJFDTotal-FJQF201712023.htm [11] 彭卫红, 王勇, 黄忠乾, 等.我国银耳研究现状与存在问题[J].食用菌学报, 2005, 12(1):51-56. DOI: 10.11821/xb200911010 [12] 罗信昌.中国银耳研究之历史回顾[J].菌物学报, 2013, 32(S1):14-19. http://manu40.magtech.com.cn/Jwxb/CN/article/downloadArticleFile.do?attachType=PDF&id=1104 [13] 孙晓燕, 蔡昌利, 徐丽莉, 等.多糖含量测定方法的比较[J].现代中药研究与实践, 2015, 29(3):58-62. http://www.docin.com/p-437174193.html [14] 李娟, 张耀庭.应用考马斯亮蓝法测定总蛋白含量[J].中国生物制品学杂志, 2000, 13(2):118-120. https://www.wenkuxiazai.com/doc/e3b7055f804d2b160b4ec0a5-3.html [15] 皮文霞, 蔡宝昌, 郭胜伟, 等.分光光度法测定山茱萸制剂中总三萜酸的含量[J].南京中医药大学学报, 2003, 19(2):99-100. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=njzy200302013&dbname=CJFD&dbcode=CJFQ [16] 邱清莲, 蔡伟江, 房家祥.石油醚与乙醚测定含糖类样品中脂肪含量的准确率比较[J].食品安全质量检测学报, 2016, 7(8):3393-3397. http://www.doc88.com/p-9166128442056.html -
期刊类型引用(3)
1. 尹国友,李姝瑜,孙婕. 即泡即食风味黑木耳的加工工艺及品质分析. 食品科技. 2023(08): 97-104 .  百度学术
百度学术
2. 陈红勇,陈泽榕,余观亮. 银耳烘干前扎孔工艺参数优化研究. 木工机床. 2023(03): 26-28 .  百度学术
百度学术
3. 李翔,徐宏,邓杰,王秋果,凌云坤,刘达玉. 响应面法优化银耳山楂红枣速溶饮料的加工工艺. 食品工业. 2020(01): 87-91 .  百度学术
百度学术
其他类型引用(1)




 下载:
下载: