蛋白核小球藻是一种普生性球形单细胞藻类,生态分布极广,在淡水、海水中均有发现[1]。随着蛋白核小球藻的价值逐渐被认识,日本、美国、苏联等国家将蛋白核小球藻开发为单细胞蛋白;20世纪80年代日本又以蛋白核小球藻开发出了保健、美容系列产品[2],我国也于2013年将蛋白核小球藻列为新资源食品[3]。
蛋白核小球藻Chlorella Pyrenoidosa分布广、生长快,含有碳水化合物、蛋白质、油脂等营养成分,具有广阔的市场前景,但经热水浸提大部分是游离氨基酸或者是变性蛋白质,而多糖耐热性好,易于提取,有利于高附加值的蛋白核小球藻开发[4, 5]。小球藻多糖属于植物多糖,是小球藻的主要生物活性成分。研究表明,小球藻多糖具有调节机体免疫[6, 7]、抗癌[8]、抗肿瘤[9]、抗病毒、抑菌[10]和抗氧化[11]等多种生物学活性。多糖的提取一般采用热水抽提法,但蛋白核小球藻细胞壁坚固[12],难以直接提取。目前对微藻细胞的破壁方法主要有反复冻融法、超声波法、微波、酶解法、液氮研磨法等以及各方法的联用,目前实验研究处于很小规模,要用于大规模生产,还需要解决有关工程设备放大问题[13, 14, 15, 16, 17, 18]。而酶解法能有效破除细胞壁,降解纤维素,使多糖从细胞中溶解出来,且作用条件温和、效率高,因此利用纤维素酶辅助提取蛋白核小球藻多糖,为蛋白核小球藻多糖的保健品及药物等的开发利用奠定理论基础。
1 材料与方法 1.1 材料与设备原料:蛋白核小球藻,中国科学院野生生物种质库;试剂:葡萄糖、硫酸、苯酚、无水乙醇,均为国产分析纯;纤维素酶(活力>15 000 U·g-1,国药集团化学试剂有限公司);设备:电热恒温水浴锅(DK-S24),上海精宏实验设备有限公司;电子天平(AL204),梅特勒-托利多仪器(上海)有限公司;循环水式多用真空泵(SHB-Ⅱ),郑州长城科工贸有限公司;旋转蒸发仪,上海申生科技有限公司;紫外分光光度计(TU-1810),北京析通用仪器有限公司;低速台式离心机(TDL-S-A)上海安亭科学仪器厂。
1.2 蛋白核小球藻多糖的提取工艺准确称取一定量蛋白核小球藻→加适量蒸馏水→调pH至4→酶解30min→灭酶→热水浸提→离心(4 500 r·min-1,10 mim)→上清液真空浓缩至原体积1/5→3倍95%乙醇醇沉→4℃过夜→离心(4 500 r·min-1,10 mim)→沉淀冷冻干燥→蛋白核小球藻多糖。
1.3 多糖含量测定[19] 1.3.1 葡萄糖标准曲线的绘制精密称取 105℃干燥至恒重的D-无水葡萄糖 0.010 00 g置于 100 mL容量瓶中,加水溶解并稀释至刻度摇匀,即配得 0.1 mg·mL-1的葡萄糖标准储备溶液备用。分别取事先配好的0.1 mg·mL-1葡萄糖溶液0、100、200、300、400、500、600、700 μL于具塞试管中,并用蒸馏水补足至1 mL,摇匀,先后迅速加5%苯酚1.0 mL和浓硫酸5.0 mL。静置10 min后,放入40℃水浴锅反应15 min,以蒸馏水为空白对照,于490 nm处测量吸光值,以葡萄糖浓度为横坐标,吸光值为纵坐标,绘制标准曲线。得到线性回归方程为:Y=8.37X-0.083,R2=0.991 5。
1.3.2 单因素试验准确称取样品2.0 g,置于100 mL锥形瓶中,以提取时间(1、2、3、4、5 h)、提取温度(20、40、60、80、100℃)、料液比(1:10、1:20、1:30、1:40、1:50)和酶质量浓度(0.5%、1.0%、1.5%、2.0%、2.5%,W/V)为单因素进行提取优化,获得蛋白核小球藻多糖后,复溶,并稀释至适宜浓度,利用苯酚-硫酸法进行多糖含量的测定,根据葡萄糖标准曲线,计算多糖提取率。每个试验做3个平行。
多糖提取率R1/%=[C*V/M]×100%,其中C为多糖质量浓度/(mg·mL-1),V为反应液体积/mL,M为原料质量/mg。
1.3.3 Box-Behnken 试验为了进一步优化多糖提取条件,根据单因素试验结果,以提取时间、提取温度、料液比和酶浓度为自变量,以多糖得率为响应值设计Box-Behnken试验。试验各因素与水平见表 1。
| 表 1 Box-Behnken设计因素及水平 Table 1 Variables and levels in 4 variables/3 levels response surface design |
(1) DPPH自由基清除能力[20]:取2 mL样品溶液,加入2 mL 0.04 mg·mL-1 DPPH溶液,混合均匀后于黑暗中放置30 min,在517 nm处测吸光值。同时设置样品对照和空白对照,样品对DPPH自由基的清除率用以下公式计算:
DPPH自由基的清除率/%=[1-(Ax-Ax0)/A0]×100%
式中AX为样品与DPPH反应的吸光值;AX0为蒸馏水代替DPPH的吸光值;A0为蒸馏水代替样品的吸光值。重复3次。
(2) 超氧阴离子自由基清除能力:利用邻苯三酚自氧化对超氧阴离子自由基清除能力进行测定[21]。取50 mmol·L-1 Tris-HCl缓冲液(pH8.2)2.5 mL,置25℃水浴中保温20 min,分别加入1 mL样品溶液和0.6 mL 25 mmol·L-1邻苯三酚溶液,混匀后于25℃水浴中反应5 min,加入0.5 mL浓盐酸终止反应,于299 nm处测定吸光度(A1),以去离子水代替样品溶液测定吸光值A0。按下式计算O2-·清除率。
O2-·清除率/%=[1-(A1-A2)/A0]×100%
式中A1为样品吸光值;A2为用蒸馏水代替邻苯三酚的吸光值;A0为蒸馏水代替样品的吸光值。重复3次。
(3) 羟自由基清除能力[22]:于1 mL样品中加入8.8 mmol·L-1 H2O2 1 mL、9 mmol·L-1 FeSO4 1 mL、9 mmol·L-1水杨酸-乙醇溶液1 mL,最后加H2O2 于37℃启动反应30 min,以蒸馏水为参比,在510 nm下测定各浓度的吸光度。考虑到样品本身的吸光值,以9 mmol·L-1FeSO4 1 mL、9 mmol·mL-1水杨酸-乙醇溶液1 mL,样品溶液1 mL和1 mL蒸馏水作为样品的本底吸收值。按下式计算·OH清除率:
·OH清除率/%=[1-(Ax-Ax0)/A0]×100%
式中AX为样品吸光值;AX0为用蒸馏水代替H2O2的吸光值;A0为蒸馏水代替样品的吸光值。重复3次。
1.5 数据分析利用Design Expert 8.0分析软件和Excel程序分析试验结果。
2 结果与分析 2.1 单因素试验结果 2.1.1 提取时间对蛋白核小球藻多糖提取率的影响在提取温度80℃,料液比1:20,酶浓度2.0%的条件下,提取蛋白核小球藻多糖,考查提取时间对蛋白核小球藻多糖提取率的影响。
由图 1 可知随着提取时间的延长,蛋白核小球藻多糖提取率逐渐升高。当提取时间超过2 h后,提取率略有下降,但变化趋于平缓。经多重比较分析,提取2 h所得多糖提取率较提取3 h差异不显著(P>0.05),但较提取1 h和5 h存在极显著差异(P<0.01),因此从提高效率角度考虑选择提取2 h为最佳提取时间。
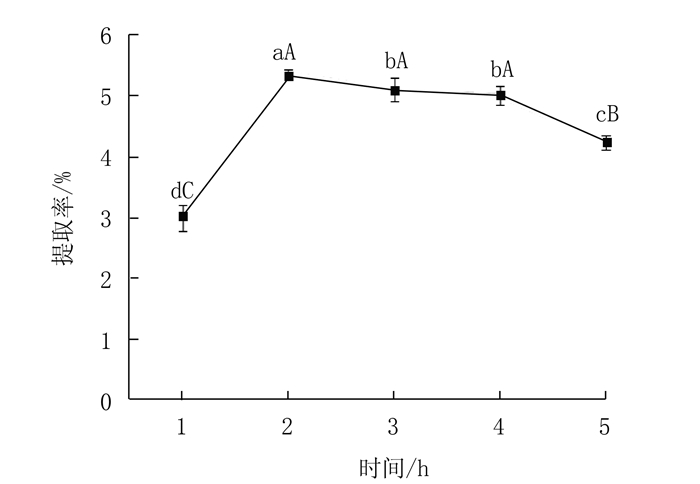
|
图 1 提取时间对多糖提取率的影响 注:用LSD法进行多重比较,同一曲线标有不同大小写字母,小写字母表示组间差异显著(P<0.05),大写字母表示组间差异极显著(P<0.01),标有相同小写字母表示组间差异不显著(P>0.05)。图 2~4、8同。 Fig. 1 Effect of extraction duration on yield of polysaccharides |
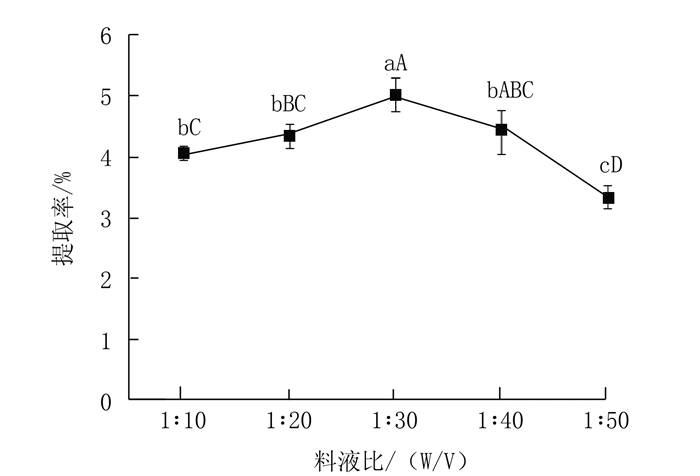
|
图 2 料液比对多糖提取率的影响 Fig. 2 Effect of substrate to liquid ratio on yield of polysaccharides |
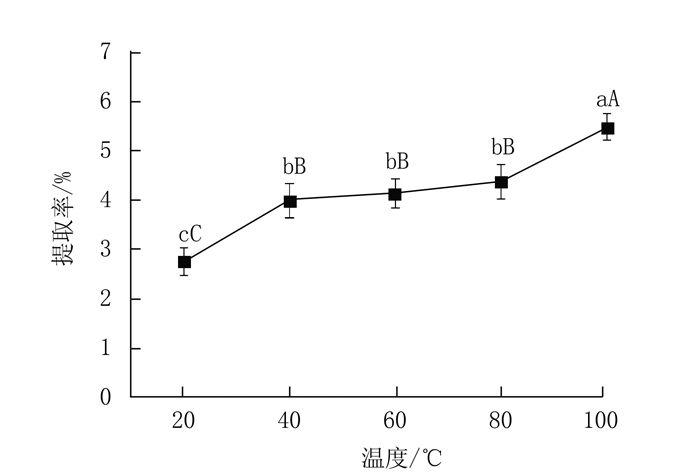
|
图 3 提取温度对多糖提取率的影响 Fig. 3 Effect of extraction temperature on yield of polysaccharides |
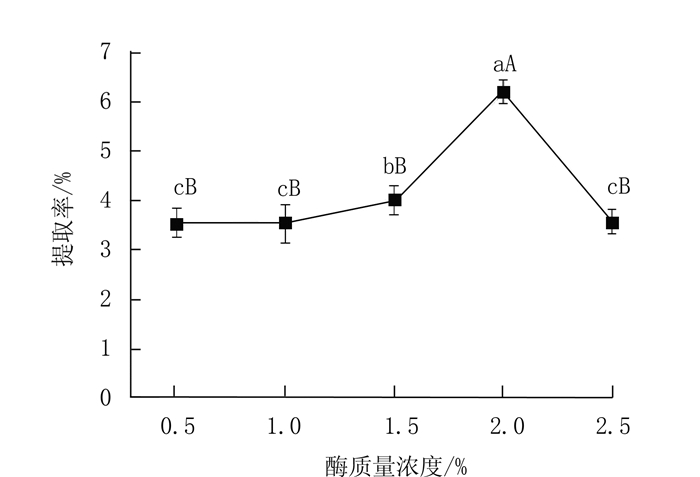
|
图 4 酶质量浓度对多糖提取率的影响 Fig. 4 Effect of cellulase concentration on yield of polysaccharides |
|
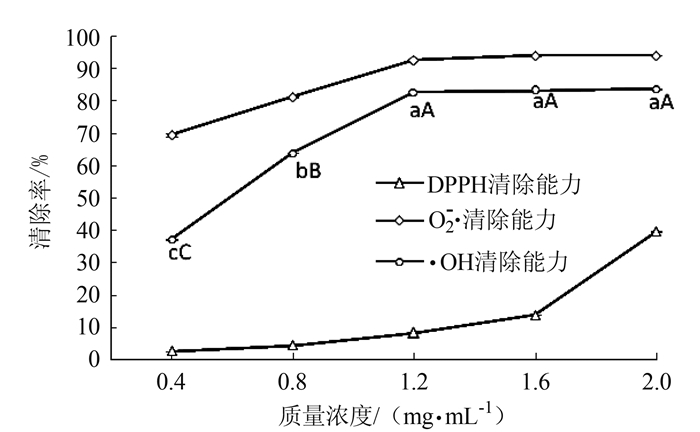
图 8 蛋白核小球藻多糖抗氧化能力 Fig. 8 Antioxidant activities of polysaccharides from C. pyrenoidosa |
在提取温度80℃,提取时间2 h,酶质量浓度2.0%的条件下,提取蛋白核小球藻多糖,考查料液比对蛋白核小球藻多糖提取率的影响。
由图 2可知在选取的料液比范围内,当料液比小于1:30时,多糖提取率随着料液比的增加而增加,当料液比达到1:30时,多糖提取率最高,显著高于其他因素(P<0.05);当料液比继续增加,多糖提取率呈现下降的趋势。当料液比太大会增加后续浓缩时间,消耗大量能量,因此选1:30为最佳料液比。
2.1.3 温度对蛋白核小球藻多糖提取率的影响在料液比为1:30,提取时间2 h,酶质量浓度2.0%的条件下,提取蛋白核小球藻多糖,考查温度对蛋白核小球藻多糖提取率的影响。
由图 3可知随着温度的升高,蛋白核小球藻多糖提取率逐渐升高。当温度达到100℃的时候,多糖提取率可达5.48%,与其他因素条件存在极显著差异(P<0.01)。这是因为随着温度的升高,所提供的能量越高,可以加快反应速度,增加多糖的溶解度,但为了节约能源及避免过高的温度对多糖活性的破坏,选取90℃为最佳温度。
2.1.4 酶质量浓度对蛋白核小球藻多糖提取率的影响在料液比为1:30,提取时间2 h,提取温度90℃的条件下,提取蛋白核小球藻多糖,考查酶质量浓度对蛋白核小球藻多糖提取率的影响。
由图 4可知当酶质量浓度在0.5%~1.5%,多糖提取率呈现增加的趋势,但未发生显著性改变(P>0.05),当酶质量浓度达到2时多糖提取率达到最大值,而后酶质量浓度继续增加,多糖提取率呈下降趋势。这是由于酶解作用时,在其他条件不变的情况下,底物浓度足以使酶饱和时,酶促反应速度与酶质量浓度存在一定的正比关系,但当酶质量浓度继续增加时,底物不足,因此即使加大酶用量,酶解作用小[23],因此选择2%酶质量浓度为最佳条件。
2.2 响应面试验结果表 2为Box-Behnken 试验结果。利用Design-Expert 8.0分析试验结果,以蛋白核小球藻多糖提取率为响应值建立四元二次回归方程:
R=+6.02+0.2A+0.56B-0.053C-0.065D+0.042 AB-0.21AC-0.23AD+0.028BC+0.19BD+0.015CD-1.18A2-0.81B2-1.08C2-1.05D2
| 表 2 响应面分析方案及试验结果 Table 2 Design and results of response surface analysis |
对该回归方程进行方差分析,结果如表 3所示。
由表 3知,该模型的F=23.12且P<0.000 1表明该模型线性关系显著;失拟项F=1.20,表明该模型拟合性好;R2adj=0.928 0,变异系数C.V.%为0.830 4落在合理范围内;R2=0.959 4说明验证方法可靠,模型可用于预测蛋白核小球藻多糖提取工艺试验结果。同时,可以看出,各因素对响应值的影响大小如下:B>A>D>C,即提取温度>提取时间>酶质量浓度>料液比,且因素A、B、AC、AD、BD、A2、B2、C2和D2对蛋白核小球藻多糖提取率有着显著性影响。
| 表 3 多糖提取率响应面试验结果方差分析 Table 3 Analysis of variance onresults of polysaccharides yield from response surface experiment |
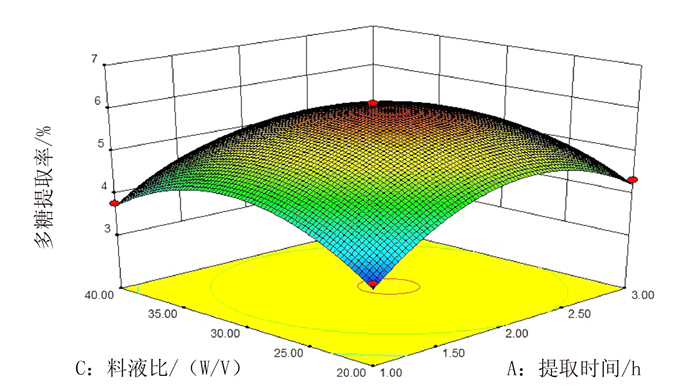
图 5表示的是当提取温度为90℃、酶质量浓度为2.0%的时候,提取时间与料液比之间的交互作用。由图 5可以看出,一定的提取时间,随着料液比的增加,多糖提取率先增加后减小;一定的料液比,延长提取时间,多糖提取率先增加后减小,与单因素的结果一致。两者的交互作用对蛋白核小球藻多糖提取率具有显著性影响(P<0.05)。
|
图 5 提取时间和料液比交互作用对蛋白核小球藻多糖提取率的影响 Fig. 5 Effect of extraction duration and substrate to liquid ratio on yield of polysaccharides from C.pyrenoidosa |
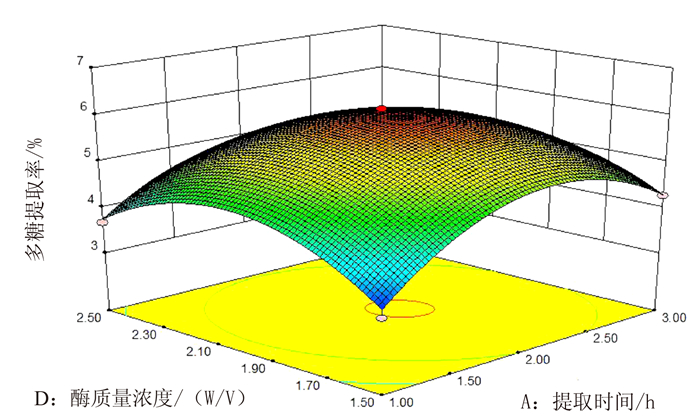
图 6表示的是当提取温度为90℃、料液比为1:30时,提取时间与酶质量浓度之间的交互作用。提取时间和酶质量浓度均较小时,多糖提取率较低,当提取时间延长和酶质量浓度增加时,多糖提取率随之增加,两者的交互作用对多糖提取率具有显著性影响(P<0.05),且提取时间对多糖提取率的影响大于酶质量浓度。
|
图 6 提取时间和酶质量浓度交互作用对蛋白核小球藻多糖提取率的影响 Fig. 6 Eeffect of extraction duration and cellulase concentration on yield of polysaccharides from C. pyrenoidosa |
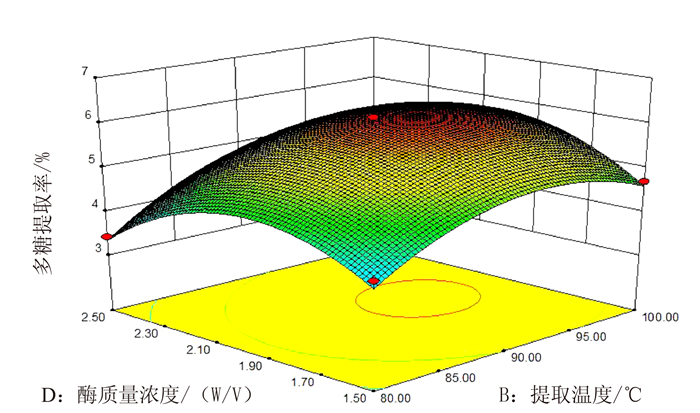
图 7表示的是当提取时间为2 h,料液比为1:30时,提取温度和酶质量浓度之间的交互作用。由图可知,当酶质量浓度固定时,多糖提取率随着温度的升高而增大,当温度在90~95℃时,提取率较大,且提取温度对多糖提取率的影响大于酶质量浓度。
|
图 7 酶质量浓度和提取温度交互作用对蛋白核小球藻多糖提取率的影响 Fig. 7 Effect of cellulase concentration and extraction temperature on yield of polysaccharides from C. pyrenoidosa |
经过响应面对蛋白核小球藻多糖提取条件进行优化得到的最佳提取条件为:提取时间2.1 h、提取温度93.51℃、提取料液比1:29.7和酶质量浓度2.00%,在该最优条件下由回归方程分析预测多糖提取率为6.13%。为方便操作,选取提取时间2 h、提取温度93℃、提取料液比1:30和酶质量浓度2%为最优条件。在该条件下,蛋白核小球藻多糖实际平均提取率为(5.87±0.24)%,与预测值接近,因此该模型可较好的对蛋白核小球藻多糖提取率进行预测。
2.3 蛋白核小球藻多糖抗氧化能力利用样品对DPPH自由基、超氧阴离子自由基和羟基自由基的清除能力来评估蛋白核小球藻多糖的抗氧化能力,结果如图 8所示。由图可知,蛋白核小球藻多糖对3种自由基均有一定的清除能力,且随着质量浓度的增加而增大,其中不同浓度的蛋白核小球藻对羟基自由基的清除能力存在显著性差异(F=33.58 > F(0.05)=3.48),但在大于1.2 mg·mL-1时对超氧阴离子自由基和羟基自由基的清除率变化趋于平缓,差异不显著(P>0.05)。然而,不同浓度的蛋白核小球藻多糖对超氧阴离子自由基和DPPH自由基的清除能力差异不显著(P>0.05)。
3 讨论与结论热水浸提,酸提法和碱提法等是比较传统的多糖提取方法。随着技术设备的发展,超声波辅助辅助提取、微波辅助提取、酶法辅助提取以其高效率受到广泛关注。谭成玉等[21]利用连续加热回流提取法、超声波提取法、闪式提取法、酶法提取以及不同方法的联用等对海洋小球藻多糖进行提取,其中以酶法辅助提取获得较高提取率。
本试验在传统的热水提取蛋白核小球多糖的基础上,利用纤维素酶进行辅助提取。在单因素的基础上,通过响应面试验对提取时间、提取温度、料液比和酶浓度4个因素进行优化,得出酶法辅助提取蛋白核小球藻多糖的最佳条件为:提取时间为2 h、提取温度为93℃、料液比为1:30和酶浓度为2%,在该条件下多糖提取率可达6.13%,实际为(5.87±0.24)%。表明响应面设计法用于蛋白核小球藻多糖提取工艺的优化筛选是可行的。虽然该方法的多糖提取率与冻融—超声小球藻多糖最高提取率5.918%接近,低于用胰蛋白酶提取的提取率7.82%,但高于加热回流提取率1.21%和热水结合超声波提取率4.480%[17, 21, 22]。
通过对羟基自由基,超氧阴离子自由基和DPPH自由基清除能力试验,可以看出蛋白核小球藻多糖具有一定的抗氧化能力,其中对超氧阴离子自由基的清除效果最好,而对DPPH自由基的清除能力相对较弱。
| [1] | 肖策,李多伟,王红敏.我国主要经济藻类中的药用成分[J].西北药学杂志,2008,(6):408-410.( 1) 1) |
| [2] | 于贞,王长海.蛋白核小球藻培养条件的研究[J].烟台大学学报:自然科学与工程版,2005,(3):206-211.( 1) 1) |
| [3] | 中华人民共和国卫生部. 关于批准蛋白核小球藻等4种新资源食品的公告[J], 中国食品添加剂, 2013,(7):227-228.( 1) 1) |
| [4] | MICRO-AND MACRO-ALGAE. Utility for Industrial Appli-cations:Outputs from the EPOBIO Project, September 2007[M]. CPL Press, 2007.( 1) 1) |
| [5] | ALAVES A, CARIDADE S G, MANO J F, et al. Extraction and physico-chemical characterization of a versatile biodegradable polysaccharide obtained from green algae[J]. Carbohydrate research, 2010, 345(15):2194-2200.( 1) 1) |
| [6] | 王凌, 孙利芹, 周妍. 蛋白核小球藻多糖体外免疫调节活性研究[J]. 食品研究与开发, 2013, 34(7):30-33.( 1) 1) |
| [7] | CHEN P B, WANG H C, LIU Y W, et al. Immunomodulatory activities of polysaccharides from Chlorella pyrenoidosa pyrenoidosa in a mouse model of Parkinson's disease[J]. Journal of Functional Foods, 2014, 11:103-113.( 1) 1) |
| [8] | 徐韬钧,张翠丽,张瑜,等. 自养小球藻多糖对人肝癌细胞SMMC-7721凋亡的诱导[J]. 天然产物研究与开发,2010, (1):45-48,92.( 1) 1) |
| [9] | SHENG J, YU F, XIN Z, et al. Preparation, identification and their antitumor activities in vitro of polysaccharides from Chlorella pyrenoidosa pyrenoidosa[J]. Food Chemistry, 2007, 105(2):533-539.( 1) 1) |
| [10] | 陈晓清, 郑怡, 林雄平. 二种微藻多糖与蛋白质提取物的抗菌活性[J]. 福建师范大学学报:自然科学版, 2005, 21(2):76-79.( 1) 1) |
| [11] | 席波, 宋东辉, 孙晶, 等. 十种微藻粗多糖的抑菌作用及海水蛋白核小球藻粗多糖的抗氧化活性[J]. 天津科技大学学报, 2015, 30(5):20-25.( 1) 1) |
| [12] | 单俊秀, 张平, 刘丽丽. 小球藻的应用研究进展[J].科技风,2010,(1):233.( 1) 1) |
| [13] | 王力. 3种不同破壁方法对椴树蜂花粉中黄酮得率的影响[J]. 科学时代, 2015,(7):.( 1) 1) |
| [14] | 孟良玉, 蔡文倩, 兰桃芳, 等. 纤维素酶对油菜蜂花粉的破壁作用[J]. 食品科学, 2012, 33(22):72-75.( 1) 1) |
| [15] | 肖海芳, 马海乐, 孙进良, 等. 基于藻红蛋白提取的条斑紫菜脉冲超声破壁方法研究[J]. 食品科学, 2008, 28(11):199-202.( 1) 1) |
| [16] | 黄贤刚, 鲁曾, 胡晓文. 超声波-反复冻融协同法优化黑木耳菌丝体破壁条件[J]. 农业科学与技术:英文版, 2014, 15(8):1258-1261.( 1) 1) |
| [17] | 魏文志, 付立霞, 陈国宏. 基于冻融辅助超声波法的蛋白核小球藻多糖提取工艺优化[J]. 农业工程学报, 2012, 28(16):270-274.( 2) 2) |
| [18] | 梁光义.中药化学[M].北京:中医古籍出版社,2005.( 1) 1) |
| [19] | MORALES-MEDINA R, TAMM F, GUADIX A M, et al.Functional and antioxidant properties of hydrolysates of sardine (S.pilchardus) and horse mackerel (T.mediterraneus) for the microencapsulation of fish oil by spray-drying[J].Food Chemistry,2016.( 1) 1) |
| [20] | LIU J, WEN X Y, ZHANG X Q, et al. Extraction, characterization and in vitro antioxidant activity of polysaccharides from black soybean[J].International Journal of Biological Macromolecules,2015.( 1) 1) |
| [21] | 谭成玉, 赵小霞, 孟繁桐, 等. 海洋小球藻多糖的制备及其体外抑制肿瘤血管生成活性的研究[J]. 中国海洋药物, 2014, 33(4):33-38.( 3) 3) |
| [22] | SHI Y, SHENG J, YANG F, et al. Purification and identification of polysaccharide derived from Chlorella pyrenoidosa[J]. Food chemistry, 2007, 103(1):101-105.( 2) 2) |
 2016, Vol. 31
2016, Vol. 31
