2. 福建省农业科学院农业生物资源研究所, 福建 福州 350003
2. Agricultural Bioresource Research Institute, Fujian Academy of Agricultural Sciences, Fuzhou, Fujian 350003, China
抗生素是微生物的代谢产物,能抑制或杀死特定微生物,曾经给人类社会带来积极的作用,但是随着耐药细菌的发现,以及耐药基因的传播[1],暴露了抗生素潜在的危机。作为抗生素的绿色替代品,益生菌因其无毒不致病[2],刺激机体免疫,抑制病原菌生长扩散[3],调节肠道菌群[4]等优点,在临床、畜禽[5]、保健、食品等行业广泛应用,例如目前国内外微生态制品的市值约为3 000亿美元[6],我国占近7%的份额。
益生菌种类繁多,包括乳酸杆菌、双歧杆菌、酵母菌等,其中芽孢杆菌因其耐受力强、酶系丰富、产生抑菌物质等独特优势,占据着益生菌市场的较大份额。芽孢杆菌可以分泌淀粉酶、纤维素酶、植酸酶等,其中蛋白酶在洗涤、皮革、饲养、食品等行业应用广泛[7],例如,Shea等[8]发现蛋白酶作为饲料添加剂可以补偿机体消化酶的不足,分解饲料中的拮抗大分子,恢复机体消化酶的活性;Huddy等以Vibrio midae SY9为饲料添加剂,提高南非鲍蛋白酶水平以促进生长[9]。已知芽孢杆菌能产生多肽、脂肽、蛋白类等多种抑菌物质[10],拮抗耐甲氧西林金黄色葡萄球菌methicillin resistant Staphylococcus aureus[11]、尖孢镰刀菌Fusarium oxysporum[12]、黄萎病原菌Verticillium dahliae[13]等。目前多从消化酶和抑菌的单一角度筛选益生芽孢杆菌,而美丽短芽孢杆菌Brevibacillus formosus FJAT-10011具备双重功能,既能拮抗肠道病原菌,又能高效水解蛋白质,更适应养殖市场的需求。
本研究筛选能水解蛋白质又能拮抗肠道细菌的芽孢杆菌,并对美丽短芽孢杆菌Brevibacillus formosus FJAT-10011的蛋白酶及其抑菌物质的性质进行研究,为菌剂的制备工艺、保藏条件及在饲料行业的有效应用提供借鉴。此外,有利于拓宽畜禽益生菌市场的微生物资源,提高经济效益,节约成本,以及保护环境。
1 材料与方法 1.1 材料 1.1.1 菌株来源待筛芽孢杆菌:70株芽孢杆菌(表1)。
| 表1 菌株初筛 Tab. 1 Initial screening on strains |
肠道细菌:金黄色葡萄球菌Staphylococcus aureus FJAT-12029、埃希氏大肠杆菌Escherichia coli FJAT-301、伤寒沙门氏菌Salmonella typhimurium FJAT-8720。
真菌:大豆炭疽病菌Colletotrichum truncatum FJAT-9253;串珠镰刀菌Fusarium moniliforme FJAT-176;尖孢镰刀菌Fusarium oxysporum FJAT-370、FJAT-9086、FJAT-30265、FJAT-30512。
以上菌株均保藏于福建省农业科学院农业生物资源研究所微生物中心。
1.1.2 培养基NA培养液:牛肉浸粉3 g、蛋白胨10 g、NaCl 5 g、蒸馏水1 000 mL,pH7.0。
脱脂牛奶培养基:脱脂奶粉10 g、牛肉浸粉3 g、蛋白胨10 g、NaCl 5 g、琼脂15~20 g、蒸馏水1 000 mL,自然pH。
PDA培养基:马铃薯200 g、葡萄糖20 g,自然pH。
马铃薯葡萄糖肉汤培养基:马铃薯浸粉5 g、葡萄糖15 g、蛋白胨10 g、氯化钠5 g,自然pH。
1.1.3 药品试剂pH5.0醋酸缓冲液:14.8 mL 0.2 mol·L-1的CH3COOH与35.2 mL 0.2 mol·L-1的CH3COONa混匀,调节pH至5.0。
pH6.0磷酸缓冲液:87.7 mL 0.2 mol·L-1的NaH2PO4与12.3 mL 0.2 mol·L-1的Na2HPO4混匀,调节pH至6.0。
pH7.0磷酸缓冲液:32 mL 0.2 mol·L-1的NaH2PO4与68 mL 0.2 mol·L-1的Na2HPO4混匀,调节pH至7.0。
pH8.0、9.0Tris-HCl缓冲液:用0.2 mol·L-1的HCl调节0.2 mol·L-1的Tris。
胰蛋白酶(1∶250)、胃蛋白酶(1∶3000)购自Amresco公司;蛋白酶K(20 mg·mL-1)购自天根生化科技有限公司;潮霉素购自罗氏诊断公司;氨苄青霉素购自生工生物工程有限公司;福林酚购自德国默克密理博公司;酪氨酸购自北京百灵威科技有限公司。
1.2 方法 1.2.1 产蛋白酶的芽孢杆菌初筛待筛选芽孢杆菌于NA平板上划线,30℃培养1 d。挑1环菌点种于脱脂牛奶平板上,以沙福芽孢杆菌Bacillus safensis FJAT-14260[14]作为阳性对照,无菌水作为空白对照,3次重复,于30℃培养2 d,挑选有透明水解圈的菌株进行抑菌效果测定[15]。
1.2.2 拮抗肠道细菌的芽孢杆菌初筛待测菌液制备:于NA平板上活化FJAT-12029、FJAT-301和FJAT-8720,各挑取1个单菌落接种于50 mL/250 mL的NA培养液中,37℃培养1 d。
指示菌双层平板制备:固体NA培养基倒下层平板,待凝固后,将加有1 μL·mL-1指示菌的半固体NA培养基倒上层平板,凝固备用。
产蛋白酶芽孢杆菌活化,挑1环菌于3种指示菌的双层平板上划约4 cm的短线,以短短芽孢杆菌Brevibacillus brevis FJAT-8672[16]作为阳性对照,无菌水作为空白对照,待测菌株重复3次,于37℃培养1 d,挑选有透明边界的菌株进行复筛。
1.2.3 产蛋白酶芽孢杆菌复筛[17]初筛后的菌株活化,各挑1环于50 mL/250 mL的NA培养液中,30℃、170 r·min-1下培养2 d。发酵液于4 000×g下离心10 min,0.22 μm无菌过滤器过滤上清液,并于-20℃下保存。
取6 mm打孔器于脱脂牛奶平板上打孔(5个·板-1),每孔添加100 μL无细胞上清液,无菌水做空白对照,FJAT-14260的无细胞上清液做阳性对照,3次重复。37℃下放置24 h后测量透明圈的直径。
1.2.4 拮抗肠道细菌芽孢杆菌复筛指示菌双层平板制备同1.2.2,待筛菌株无细胞发酵上清液的制备及抑菌筛选过程同1.2.3,FJAT-8672的无细胞上清液作阳性对照,其他相同。
1.2.5 美丽短芽孢杆菌Brevibacillus formosus FJAT-10011蛋白酶酶学性质研究[18]
(1)温度对蛋白酶活性的影响: 以1%的酪蛋白溶液为底物,分别在不同温度(25、30、40、50、60℃)下测定无细胞上清液的活力(此处及以下无细胞上清液制备方法同1.2.3)。将上清液在不同温度(30、35、40、45、50℃)下保温30 min,然后与1%酪蛋白反应测定酶的温度稳定性。此处及以下蛋白酶活力具体测定方法参照美丽短芽胞杆菌Brevibacillus formosus FJAT-10011抑菌效应及其产蛋白酶条件优化[19]。
(2)pH对蛋白酶活性的影响[20]: 以不同pH(5.0、6.0、7.0、8.0、9.0)的缓冲液配制1%酪蛋白溶液,并分别2倍稀释上清液,测定上清液的最适反应pH。不同pH(5.0、6.0、7.0、8.0、9.0)的缓冲液2倍稀释上清液,并于4℃下放置60 min,调节稀释上清液到pH7.0,然后与1%酪蛋白溶液反应以测定上清液的pH稳定性。
1.2.6 美丽短芽孢杆菌Brevibacillus formosus FJAT-10011抑菌特性研究(1)温度对抑菌效果的影响: 将发酵上清液于不同温度(40、50、60、70、80℃)下保温60 min,冰水冷却,0.22 μm的无菌过滤器过滤,制备大肠杆菌双层平板(方法见1.2.2),6 mm打孔器打孔,取100 μL处理后的上清液加于孔中,未处理上清液作对照,重复3次,30℃培养24 h后观察抑菌圈的直径。
(2)pH对抑菌效果的影响[21]: 以0.5 mol·L-1的NaOH、HCl将上清液调成不同pH(5.0、6.0、7.0、8.0、9.0),4℃下放置60 min,再将pH调回7.0,0.22 μm的无菌过滤器过滤,其他操作同1.2.6(1)。
(3)蛋白酶对抑菌效果的影响[22]: 将发酵上清液分成2组,每组3份,一组分别调成胰蛋白酶(pH7.0~8.0)、胃蛋白酶(pH1.0~2.0)和蛋白酶K(pH7.0~7.5)的最适pH[23],另一组不调pH,分别添加3种蛋白酶溶液(浓度20 mg·mL-1),终浓度为1 mg·mL-1,在37℃下处理60 min,100℃水浴10 min灭活3种蛋白酶。0.22 μm的无菌过滤器过滤,其他操作同1.2.6(1),以未处理的上清液和无菌水为对照。
(4)对真菌的抑制效果: PDA平板培养6种真菌,3 d后挑取孢子,于50 mL/250 mL PDA培养液或马铃薯葡萄糖肉汤中培养3 d,30℃、170 r·min-1。分别吸取1 mL的6种真菌菌液于45℃的半固体PDA(50 mL)中,摇匀,倒入下层为PDA固体的培养皿内。凝固后,用6 mm打孔器打取5个孔,向孔内加入FJAT-10011的无细胞上清液100 μL,以无菌水和1 mg·mL-1的潮霉素为对照,重复3次。30℃放置培养3 d,测定抑制真菌的抑菌圈直径。
1.3 统计与分析试验数据结果采用统计软件SPSS 17.0处理,对数据进行方差分析,差异显著采用Duncan方法检验。
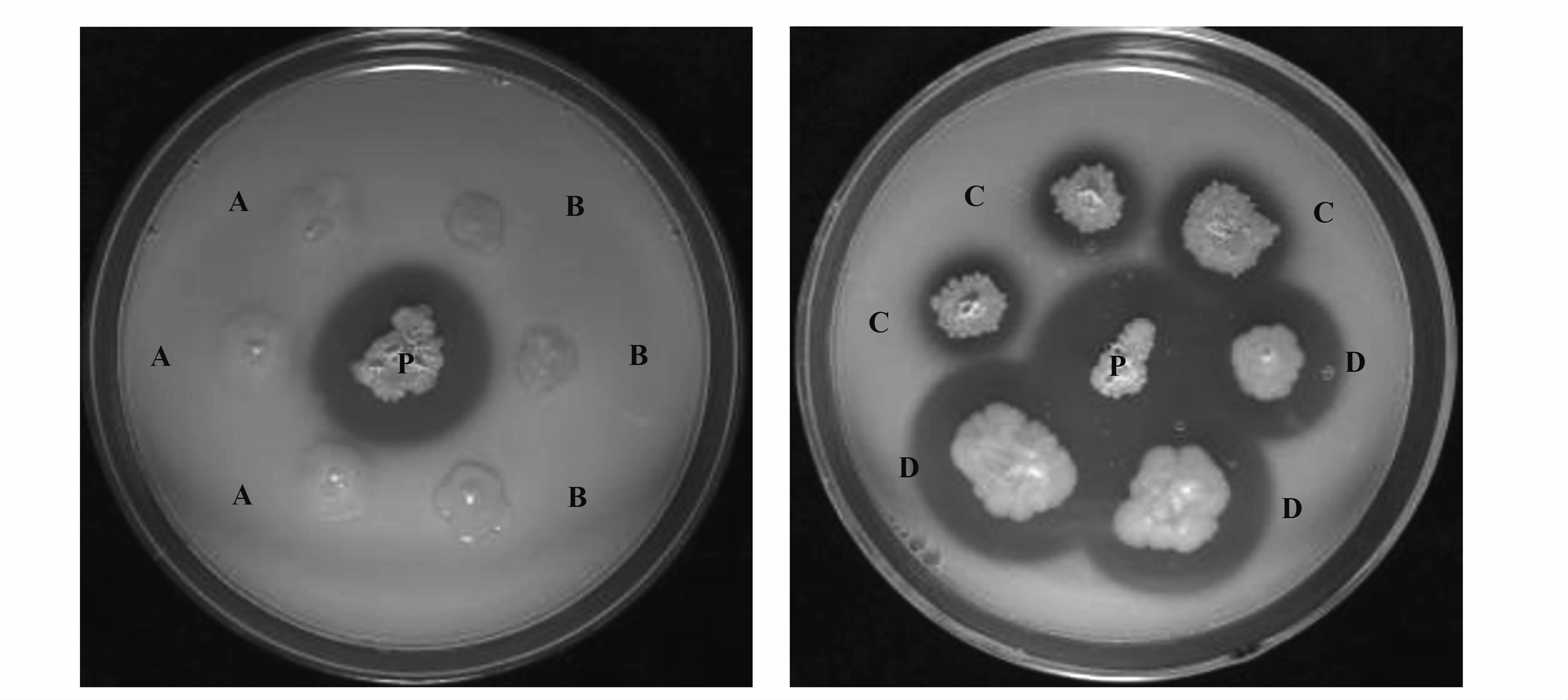
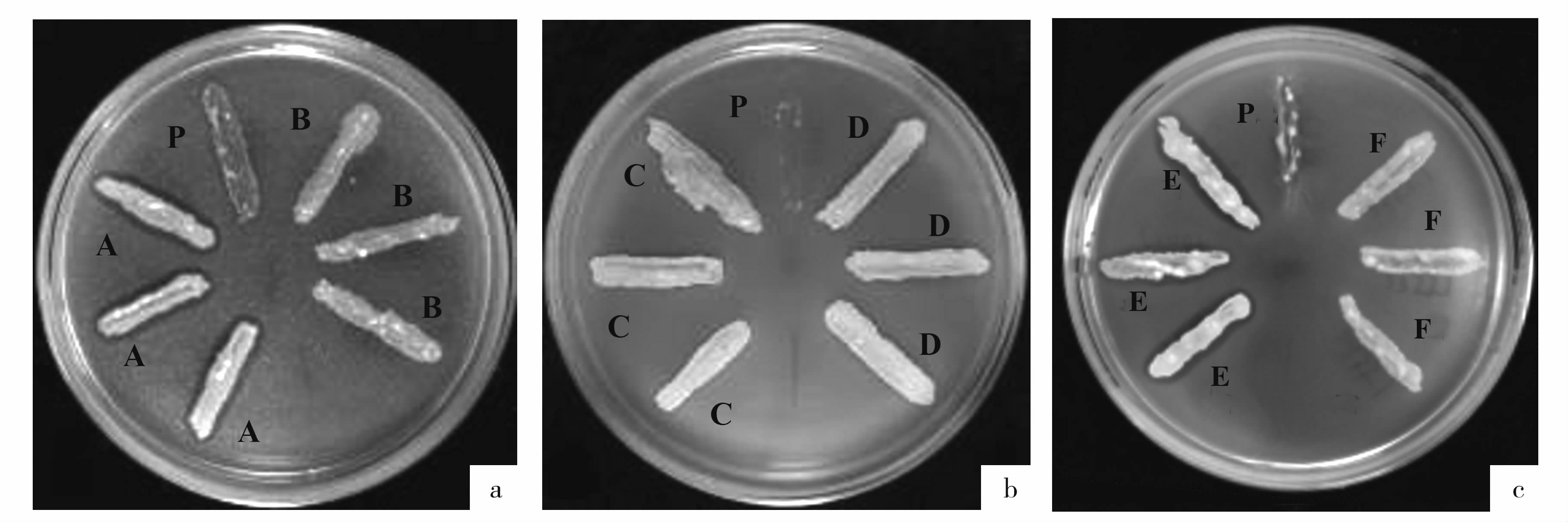
2 结果与分析 2.1 产蛋白酶芽孢杆菌初筛筛选结果见表1、图1~图2,70株待筛芽孢杆菌中55株有蛋白水解能力,15株既有蛋白水解能力,又对金黄色葡萄球菌Staphylococcus aureus、埃希氏大肠杆菌Escherichia coli和伤寒沙门氏菌Salmonella typhimurium 3种肠道细菌有抑制作用。
|
图1 蛋白酶初筛 Fig.1 Initial screening on proteases 注:A、B、C、D、P分别代表FJAT-16847、FJAT-23521、FJAT-16805、FJAT-16902和FJAT-14260。 |
|
图2 抑菌初筛 Fig.2 Initial screening on antibacterial substances 注:A、B、C、D、E、F、P分别代表FJAT-16830、FJAT-16829、FJAT-24323、FJAT-24311、FJAT-10017、FJAT-23551和FJAT-8672;a、b、c分别代表指示菌FJAT-12029、FJAT-301、FJAT-8720。 |
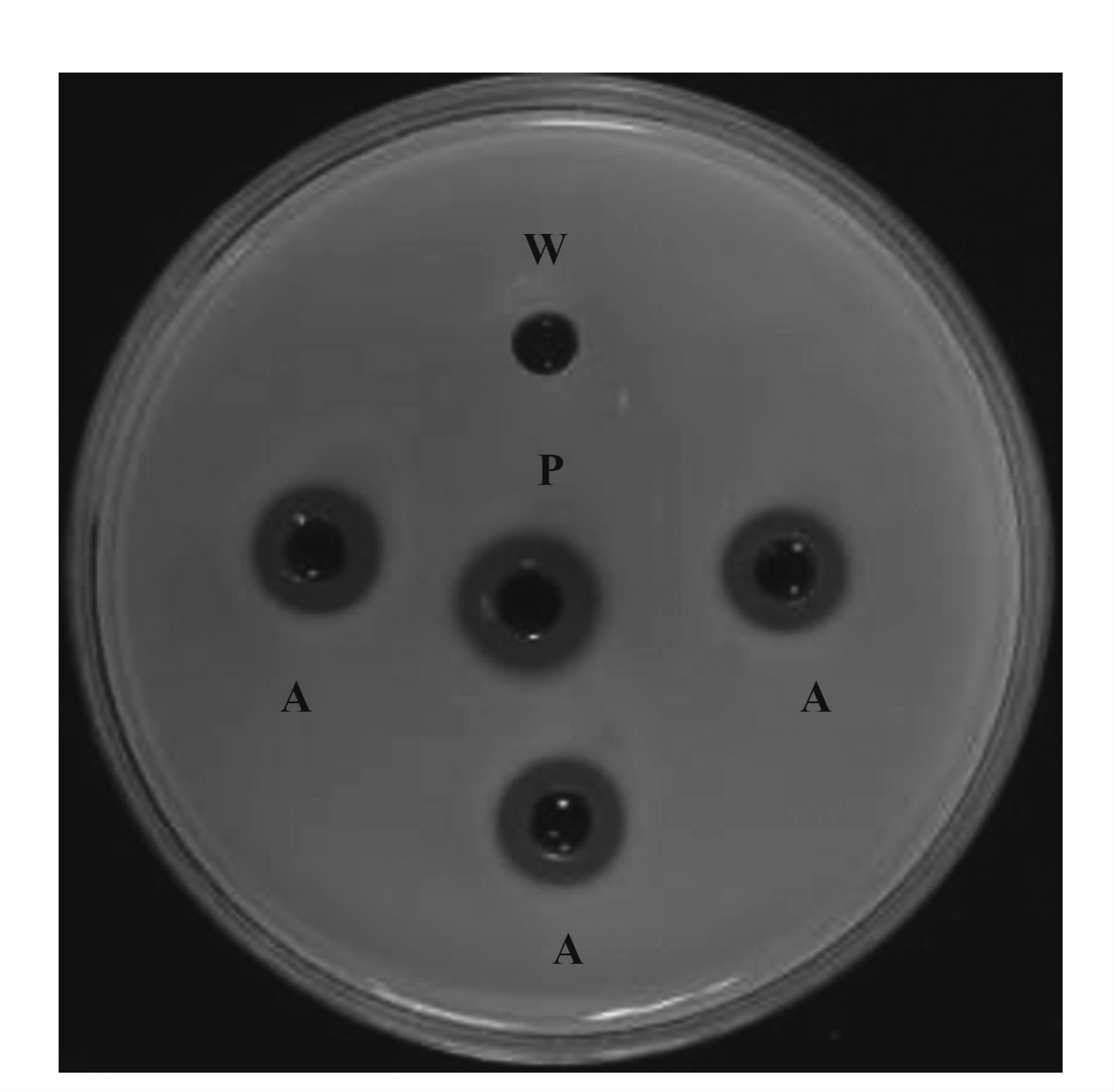
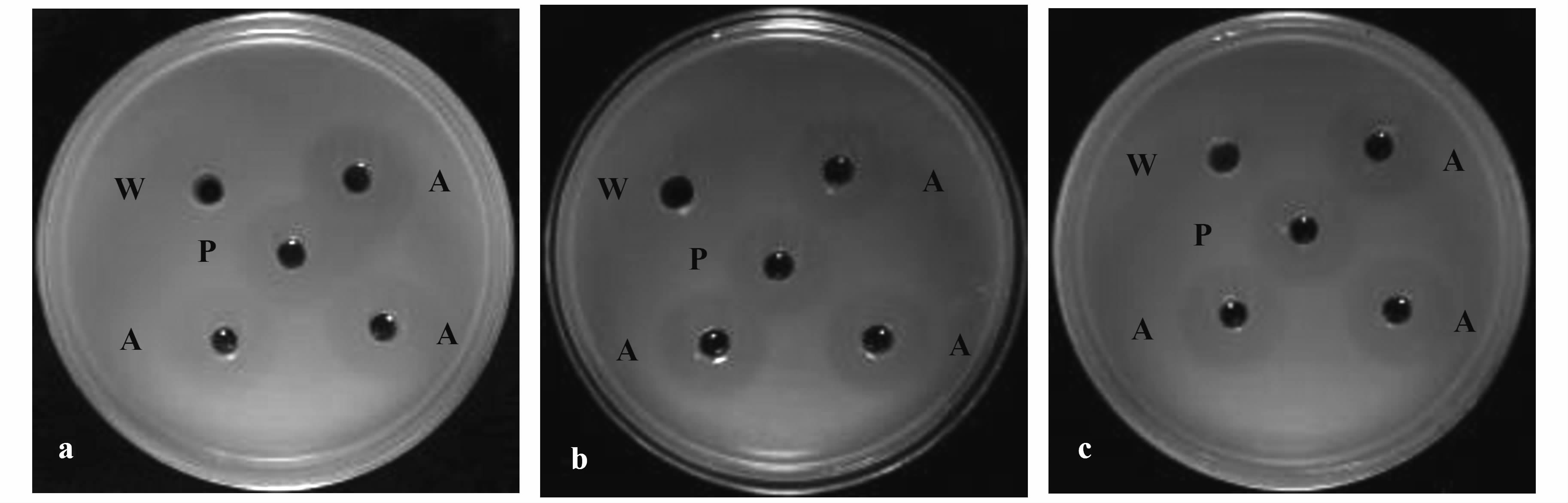
菌株蛋白酶及抑菌复筛结果见图3和图4,FJAT-10011透明圈的平均直径12.61 mm,约为阳性对照FJAT-14260的91%;初筛后的16株菌中FJAT-10011能同时抑制FJAT-12029、FJAT-301和FJAT-8720等3种肠道细菌,抑菌圈平均直径分别为18.68、20.43、21.36 mm,分别是阳性对照FJAT-8672的102%、103%、99%。
|
图3 蛋白酶复筛 Fig.3 Rescreening on proteases 注:A、W、P分别代表FJAT-10011、无菌水、FJAT-14260。 |
|
图4 抑菌复筛 Fig.4 Rescreening on antibacterial substances 注:A、W、P分别代表FJAT-10011、无菌水、FJAT-8672;a、b、c分别代表指示菌FJAT-12029、FJAT-301、FJAT-8720。 |
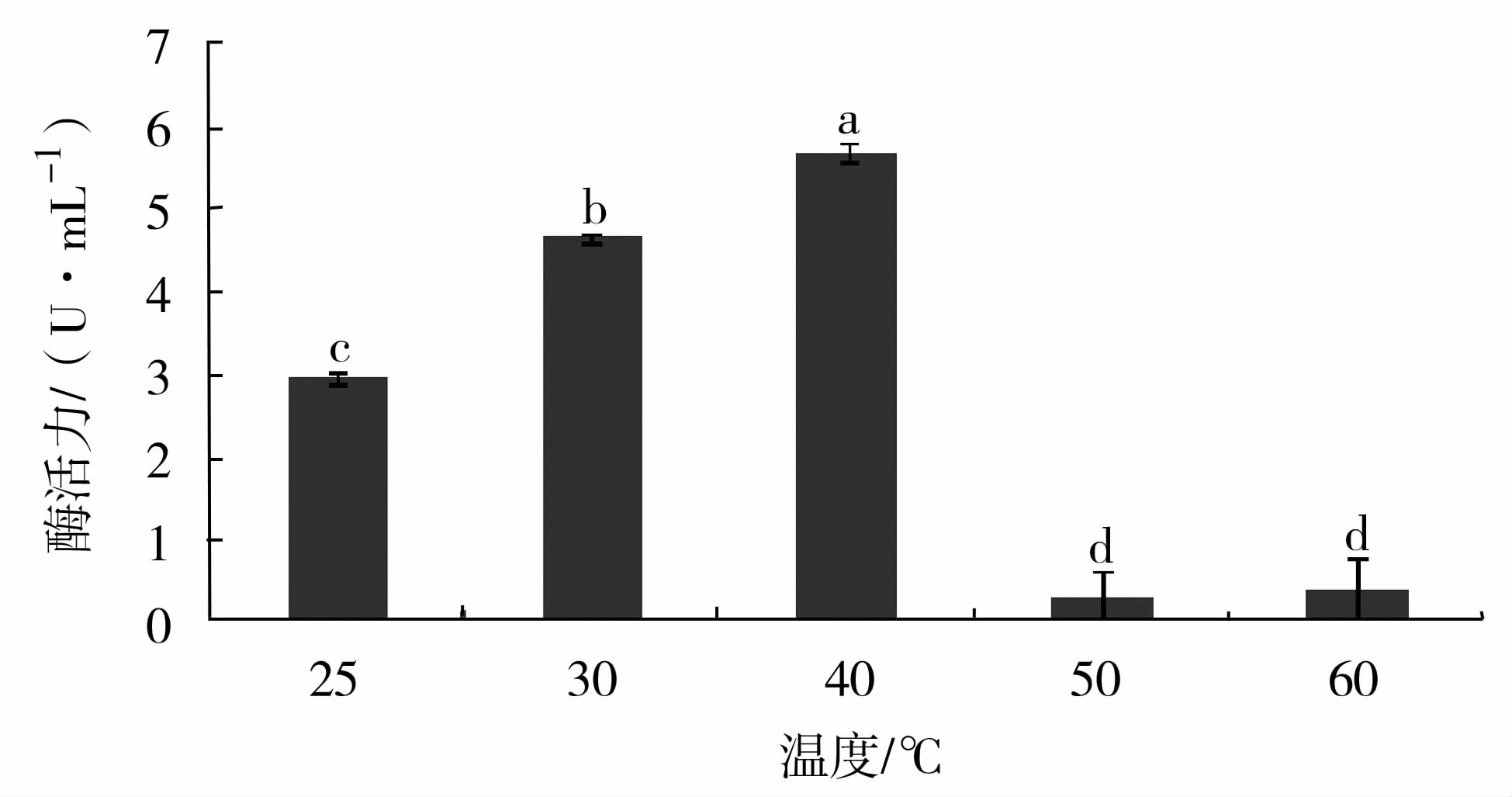
不同温度对蛋白酶活力的影响见图5。低于40℃时,酶活力随温度升高而增加,25℃和40℃的酶活力分别为2.97、5.69 U·mL-1,40℃酶活力为25℃时的1.9倍,并且显著高于其他温度的蛋白酶活力(P<0.05);高于40℃时,酶活力随温度升高而降低,50℃时的酶活力为0.31 U·mL-1,不足40℃时的6%,50℃和60℃对蛋白酶活力的影响差异不显著,说明该蛋白酶的作用温度范围窄,对高温敏感。
|
图5 温度对蛋白酶活性影响 Fig.5 Effect of temperature on protease activity 注:不同小写字母表示处理间差异显著(P<0.05),下同。 |
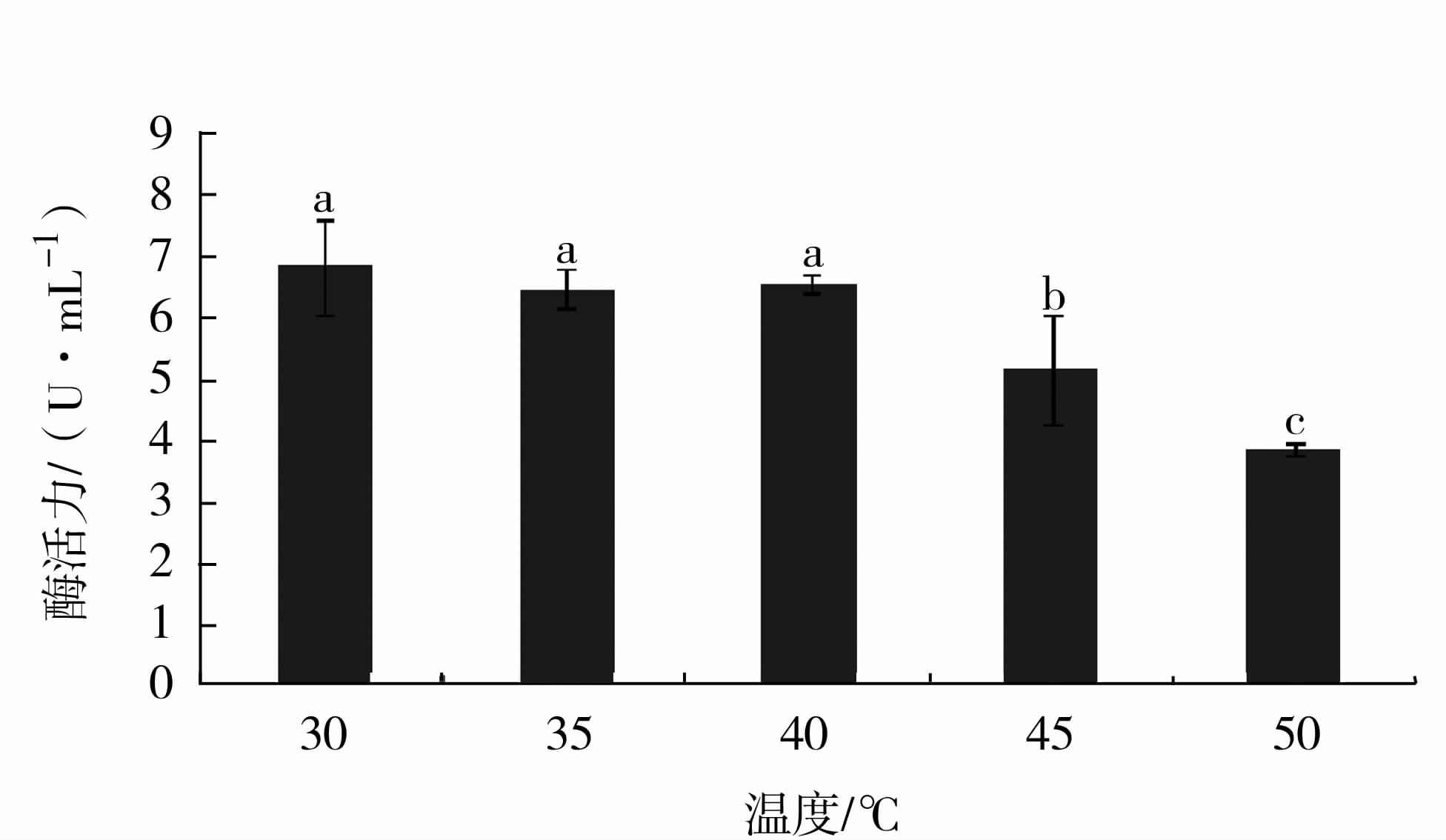
酶的热稳定性结果见图6。上清液残余酶活力随温度升高而降低,30℃下保存60 min的酶活力为6.87 U·mL-1,50℃时酶活力为3.88 U·mL-1,仅为30℃下残余酶活的57%,低于45℃时残余酶活力高于75%,说明该蛋白酶在低于45℃下热稳定性较好,低于40℃的温度对蛋白酶稳定性的影响差异不显著,而高于40℃后差异显著(P<0.05)。
|
图6 温度对蛋白酶稳定性的影响 Fig.6 Effect of temperature on stability of protease |
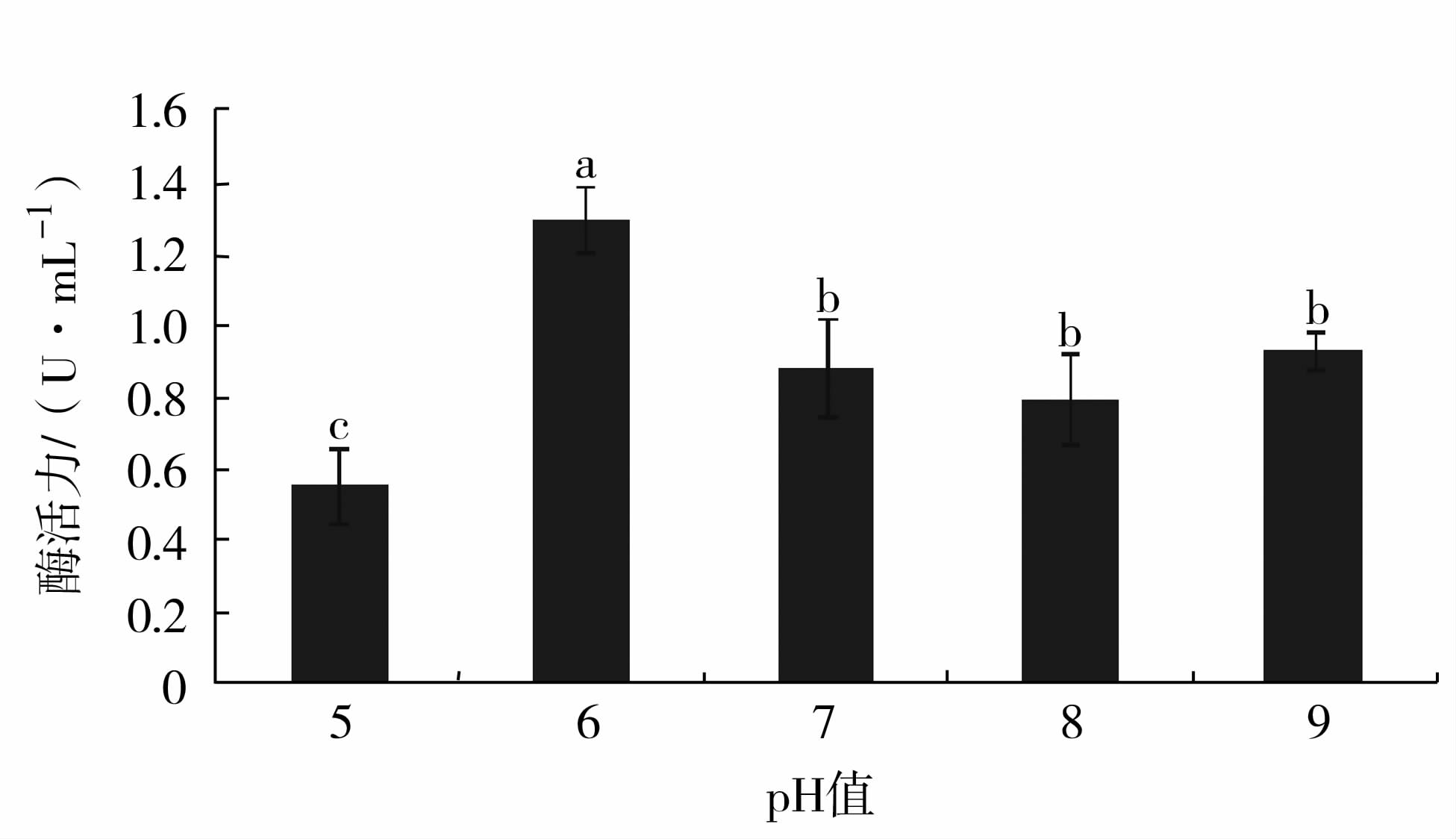
上清液在不同pH的缓冲体系下测定的酶活力结果见图7。 pH6.0上清液活力为1.30 U·mL-1,看作100%,pH7.0~9.0之间的相对酶活力在61%以上,且蛋白酶活力差异不显著,pH5.0的酶活力为0.56 U·mL-1,仅为pH6.0上清液活力的43%,蛋白酶活力显著低于其他pH值(P<0.05),说明该蛋白酶的最适作用pH在6.0左右[25]。
|
图7 pH对蛋白酶活性影响 Fig.7 Effect of pH on protease activity |
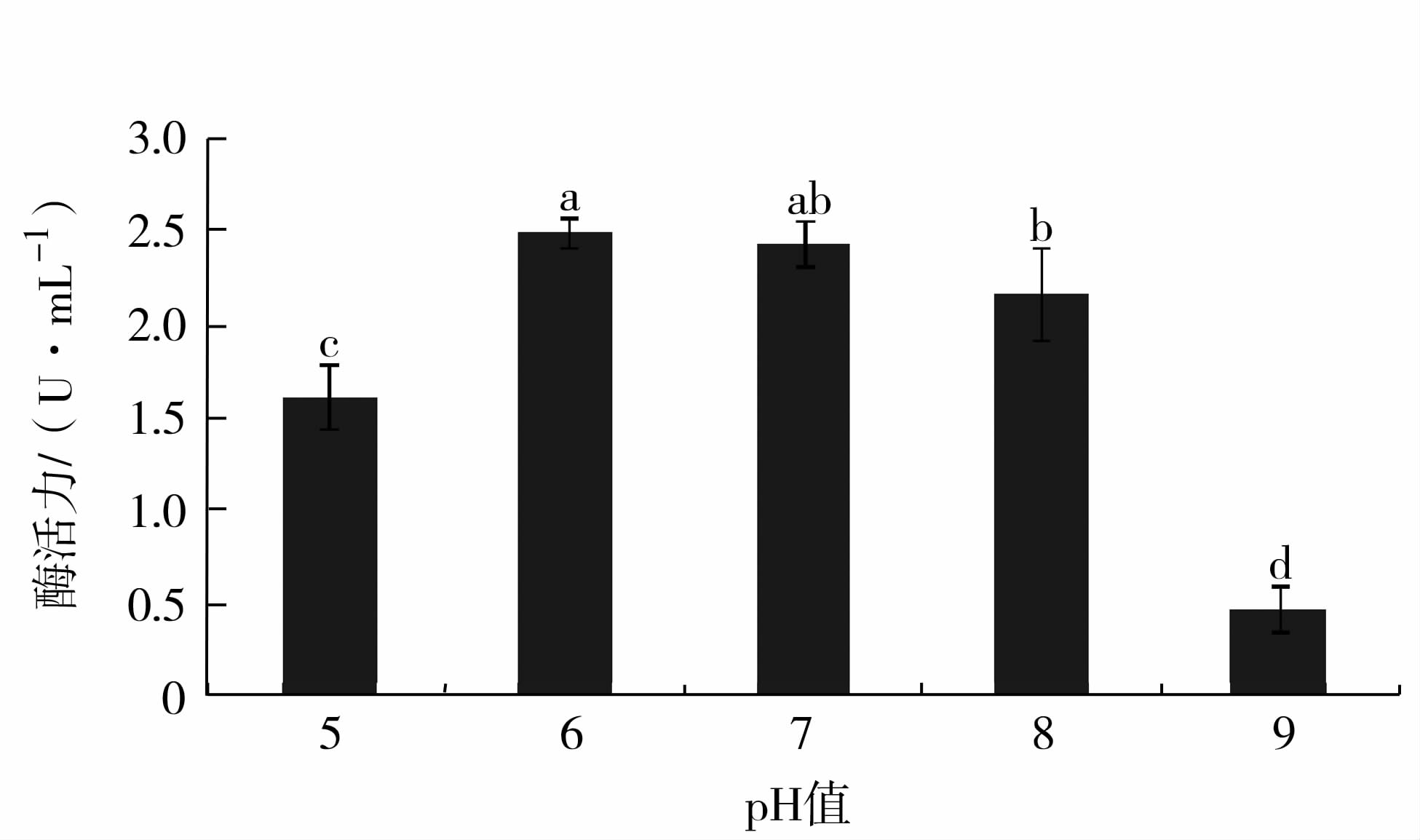
蛋白酶在一系列不同pH缓冲液中4℃处理60 min后残留酶活力见图8。pH6.0、4℃保存1 h的上清液蛋白酶活力为2.50 U·mL-1,看作100%,在pH5.0~8.0的范围内,相对酶活力维持在64%以上,pH9.0时酶活力为0.47 U·mL-1,相对酶活为19%,与其他pH下的蛋白酶稳定性差异显著(P<0.05),说明此蛋白酶的酸碱耐受范围窄,为pH6.0~8.0。
|
图8 pH对蛋白酶稳定性的影响 Fig.8 Effect of pH on stability of protease |
发酵上清液热稳定性测定结果见图9。40℃下保温1 h后上清液的抑菌直径为14.84 mm,将其看作100%,随着保存温度的升高,上清液对大肠杆菌的抑菌圈直径减小,80℃下上清液的抑菌直径为12.47 mm,相对抑菌效果为84%,与其他温度下的抑菌效果差异显著(P<0.05),这说明发酵液中的抑菌物质是耐高温的。
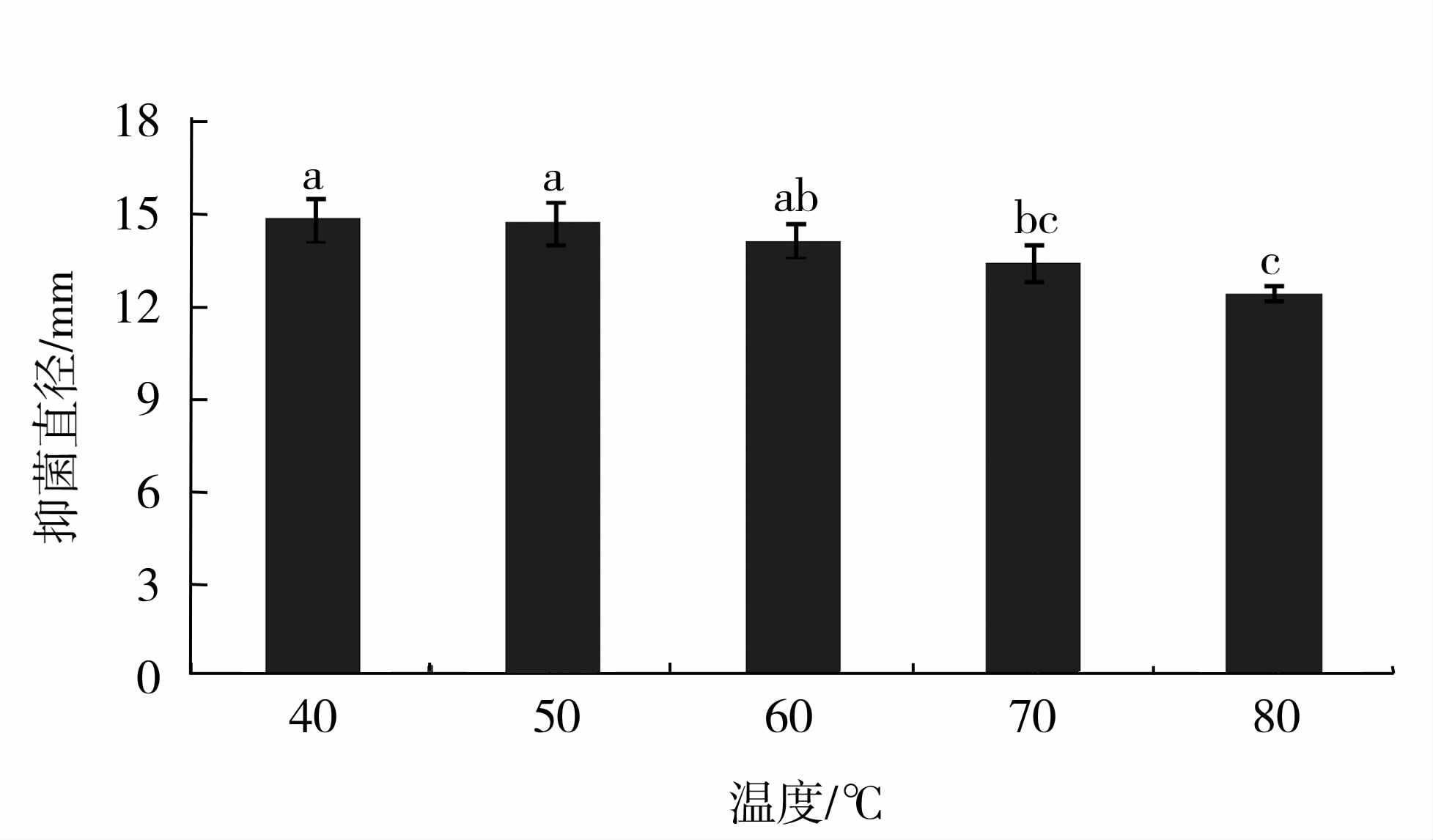
|
图9 温度对抑菌物质稳定性的影响 Fig.9 Effect of temperature on stability of antibacterial substance |
上清液酸碱稳定性测定结果见图10。pH7.0下保存1 h后上清液的抑菌直径为13.56 mm,看作100%,pH5.0和pH9.0的抑菌直径分别为8.22、9.23 mm,相对抑菌能力分别为61%、68%,各pH对抑菌物质的稳定性影响差异显著(P<0.05)。抑菌物质更适合保存在中性条件,比起酸性环境,上清液更能耐受碱性。
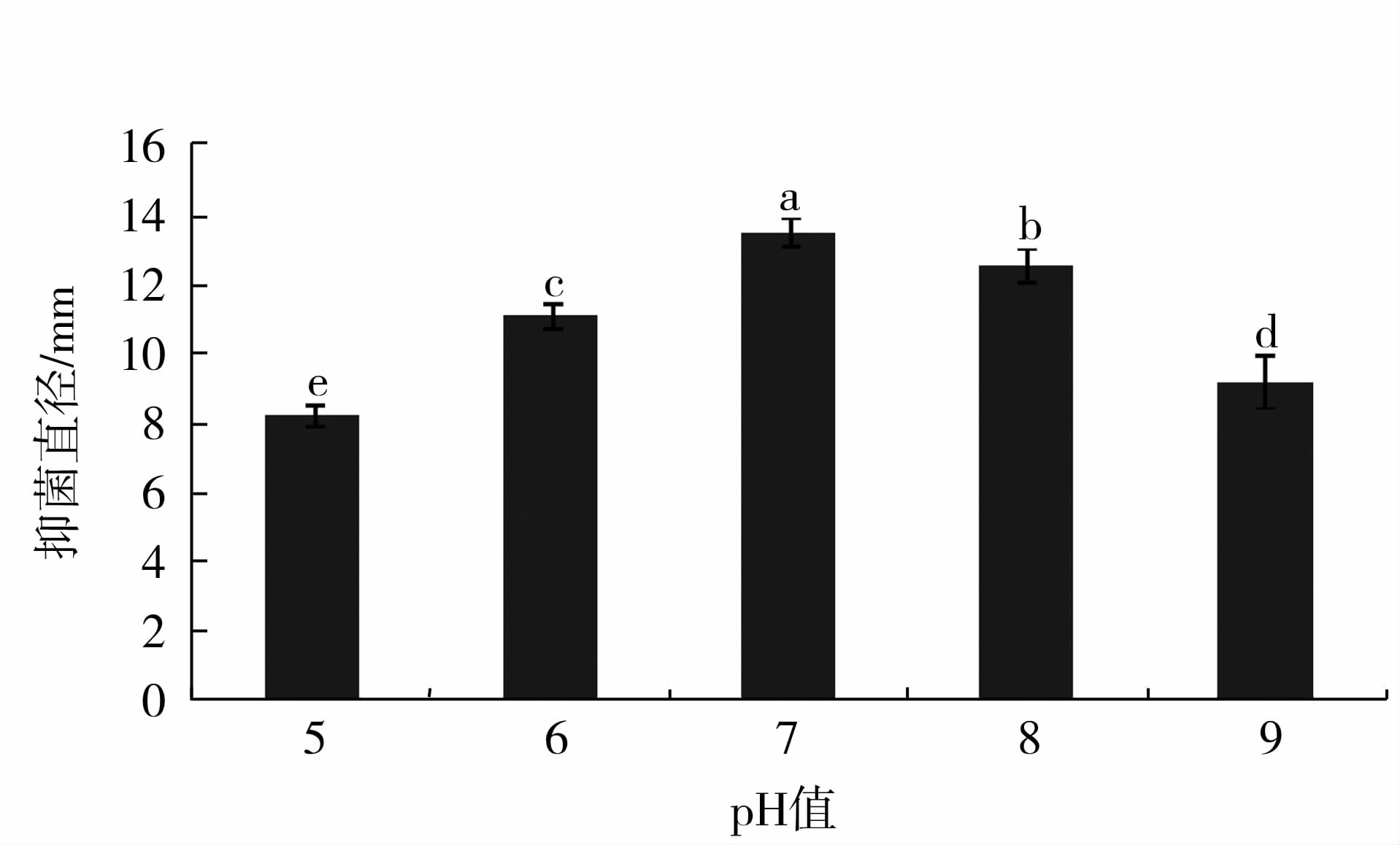
|
图10 pH对抑菌物质稳定性的影响 Fig.10 Effect of pH on stability of antibacterial substance |
通常以抑菌物质是否被蛋白酶降解作为区分细菌素与类细菌素的标准。上清液经3种蛋白酶处理后,检测其抑菌活性,结果见图11。发酵上清液本身的pH为8.45,HCl调节上清液的pH至偏碱性时,抑菌效果仍保留92%以上,调节至pH1.0~2.0时,抑菌活性大幅度降低甚至丧失。100℃水浴10 min后抑菌活性保留83%以上,不管是否调节上清液的pH,添加蛋白酶之后再水浴的抑菌效果只比直接水浴的抑菌效果降低0%~3%。说明抑菌物质对极高温、过酸性环境敏感,但对蛋白酶K、胃蛋白酶、胰蛋白酶不敏感。
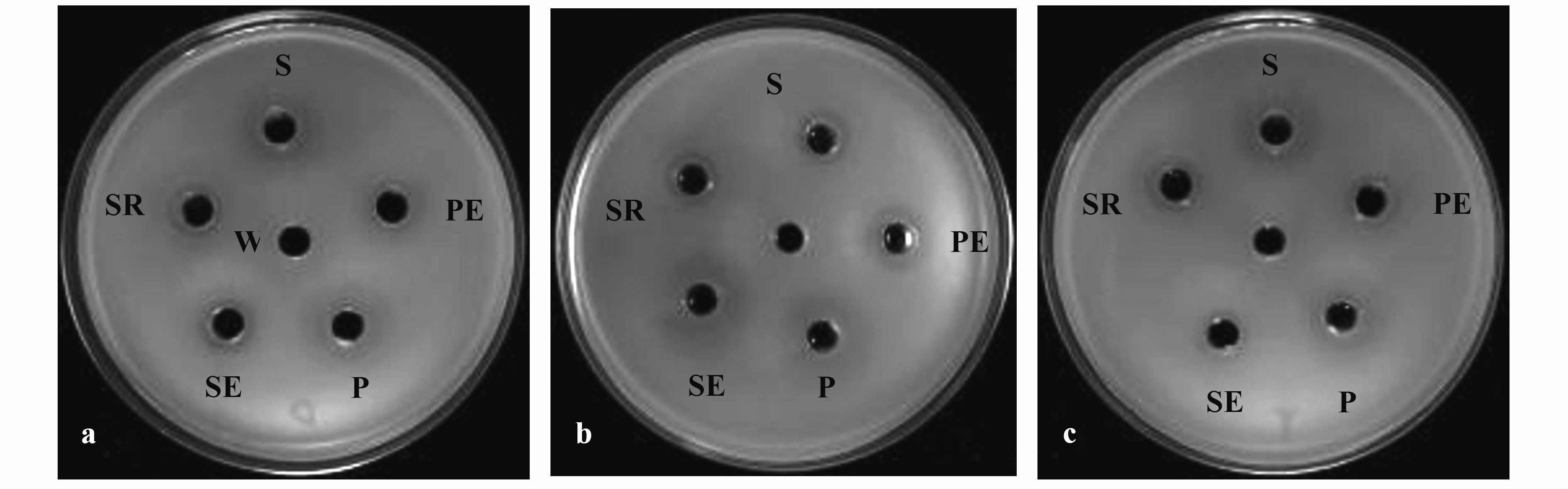
|
图11 蛋白酶K、胃蛋白酶和胰蛋白酶对抑菌物质稳定性的影响 Fig.11 Effect of proteinase K,pepsin and trypsin on stability of antibacterial substance 注:W为无菌水;S为上清液;SE为加酶上清液;PS为调pH上清液;PE为调pH加酶上清液;RS为加热上清液。a、b、c分别是添加蛋白酶K、胃蛋白酶、胰蛋白酶。 |
由图12可知,FJAT-10011发酵上清液不仅对3种肠道细菌有抑制作用,对多种枯萎病来源的尖孢镰刀菌同样有较好的拮抗效果,对FJAT-30265、FJAT-9086、FJAT-370、FJAT-30512、FJAT-176的抑制作用分别相当于1 mg·mL-1潮霉素的94.8%、101.16%、97.15%、98%、81%,但是对于FJAT-9253的拮抗效果非常微弱,不表现抑菌圈,且潮霉素对该菌的抑制效果随时间的延长也会丧失。
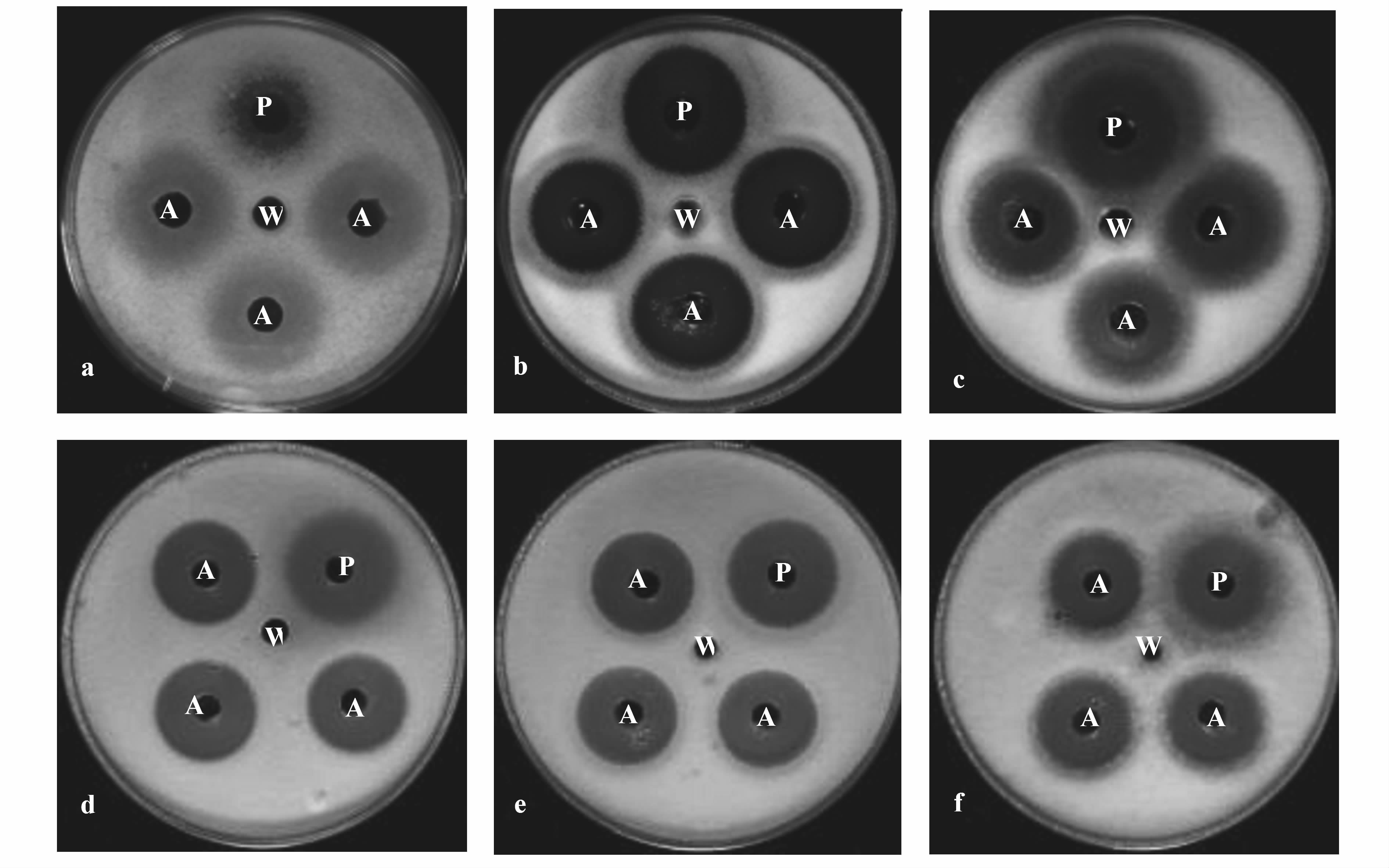
|
图12 蛋白酶对抑菌物质稳定性的影响 Fig.12 Proteinase on stability of antibacterial substance 注:a、b、c、d、e、f分别是FJAT-9253、FJAT-176、FJAT-30512、FJAT-370、FJAT-9086、FJAT-30265;P、W、A分别为潮霉素、无菌水和FJAT-10011发酵上清液。 |
致病性尖孢镰刀菌Fusarium oxysporum是引起植物枯萎病的世界性土传真菌病害,从根部侵染后引起维管束病害,给生产带来巨大损失,目前危害棉花、西瓜、大豆、番茄等作物[26],美丽短芽孢杆菌Brevibacillus formosus FJAT-10011对尖孢镰刀菌的抑制效果可以应用于植物病害的生物防治中。
3 讨 论孙志颖等从健康的鸡肠道内分离到拮抗大肠杆菌的枯草芽抱杆菌Bacillus subtilis,抑菌直径为15.4 mm[27];美丽短芽孢杆菌Brevibacillus formosus FJAT-10011复筛后抑菌直径大于20 mm,具有更强的抑菌效果。孟小亮等从正常养殖的黄颡鱼肠道中分离得到地衣芽孢杆菌Bacillus licheniformis HS140具有强的淀粉酶、脂肪酶和蛋白酶活性,H/D均大于3[28],FJAT-10011在干酪素平板上的H/D大于4。以上均说明筛选到的芽孢杆菌FJAT-10011具有良好的发展潜力。
国内外关于美丽短芽孢杆菌Brevibacillus formosus抑菌和酶学特性的研究极少,2013年Gholizadeh S S等[29]从伊朗设拉子分离到美丽短芽孢杆菌Brevibacillus formosus B22,该菌株对蛋白酶K敏感,pH7.0、35℃下抑菌活性最强。本研究菌株FJAT-10011抑菌物质极其耐高温,80℃水浴30 min后仍保留原始抑菌能力的80%,有广阔的应用温度范围。此外,抑菌物质对酸性环境的敏感度略高,中性环境下的抑菌活性更高,如果要应用于单胃动物的添加剂时还需要对抑菌物质进行处理,如微囊化,以延长保留期。唐兵等[30]研究嗜热脂肪芽孢杆菌Bacillus stearothermophilis WF145的酶学性质,最适作用pH和温度分别为8.0、80℃,具有良好的pH稳定性及热稳定性。FJAT-10011的蛋白酶最适反应温度和pH分别为40℃、6.0,在低于40℃、中性pH环境下酶活力稳定性高,说明该菌株的蛋白酶作用环境温和。
对产蛋白酶并拮抗肠道细菌的益生芽孢杆菌的筛选,以及对美丽短芽孢杆菌Brevibacillus formosus FJAT-10011蛋白酶和抑菌物质性质的研究,能够丰富益生菌菌株资源库,节约成本,提高经济效益。但目前研究只停留在抑菌特性的研究上,仍可以从抑菌物质的分离纯化、成分分析以及产品制备等方面着手探索,此外还可以完善FJAT-10011的抑真菌谱图,以及对植物的生物防治效果。
| [1] | RANDALL S S, ROGER F, HENRIK C W, et al. Antibiotic resistance-the interplay between antibiotic use in animals and human beings[J]. The Lancet Infectious Diseases, 2009, 3(1): 47-51.( 1) 1) |
| [2] | 李雯静, 肖运才, 毕丁仁, 等. 畜禽用益生菌的研究进展[J]. 中国医药科学, 2013, 3(6):37-39.( 1) 1) |
| [3] | IBRAHIM A N, JONATHAN P O, BEN C M, et al. Prebiotic and probiotic agents enhance antibody-based immune responses to Salmonella Typhimurium infection in pigs[J]. Animal Feed Science and Technology, 2015,201:57-65.( 1) 1) |
| [4] | 董秋月, 陈檬燕, 辛杨, 等. 益生菌的筛选及安全性研究进展[J]. 食品研究与开发, 2012, 33(10):228-231.( 1) 1) |
| [5] | 许维娜. 益生菌的研究进展[J]. 生物技术世界, 2012, (5):33-35.( 1) 1) |
| [6] | 曾子丹, 姚朔影. 益生菌的研究前景及国内外发展状况[J]. 食品工业科技, 2007, 28(8): 251-253.( 1) 1) |
| [7] | SHIV S, RYALI S L. Biophysicochemical Characterization of an Alkaline Protease from Beauveria sp. MTCC 5184 with Multiple Applications[J]. Applied Biochemistry and Biotechnology, 2015, 175(1) :589-602.( 1) 1) |
| [8] | SHEA C J O, MC ALPINE P O, SOLAN P, et al. The effect of protease and xylanase enzymes on growth performance, nutrient digestibility, and manure odour in grower-finisher pigs[J].Animal Feed Science and Technology,2014,189:88-97.( 1) 1) |
| [9] | ROBERT J H, VERNON E C. Characterisation of the role of an alkaline protease from Vibrio midae SY9 in enhancing the growth rate of cultured abalone fed a probiotic-supplemented feed[J].Aquaculture, 2015, 448(1): 128-134.( 1) 1) |
| [10] | 张娟, 杨彩梅, 曹广添, 等. 解淀粉芽胞杆菌及其作为益生菌的应用[J]. 动物营养学报,2014, 26(4): 863-886.( 1) 1) |
| [11] | 刘佳. 抑耐甲氧西林金黄色葡萄球菌(MRSA)芽胞杆菌的筛选及抑菌物质提取[D]. 北京: 中国农业大学, 2007.( 1) 1) |
| [12] | 雷白时. 西瓜枯萎病拮抗芽胞杆菌HD-5菌株的筛选与发酵工艺[D]. 保定: 河北农业大学, 2012.( 1) 1) |
| [13] | 王慧萍. 拮抗性芽泡杆菌F53抑制茄子黄萎病菌(Verticillium dahliae)的研究[D]. 南京: 南京农业大学, 2005.( 1) 1) |
| [14] | 刘程程, 刘波, 蓝江林,等. 产木聚糖酶芽胞杆菌的筛选及产酶条件优化[J]. 福建农业学报, 2014,29(8):757-767.( 1) 1) |
| [15] | 徐雅芫, 李吕木, 许发芝, 等. 一株产碱性蛋白酶芽胞杆菌的筛选、鉴定及应用初探[J]. 激光生物学, 2011, 13(6): 830-837.( 1) 1) |
| [16] | 车建美, 刘波, 蓝江林. 短短芽孢杆菌JK-2的GFP标记及其抑菌作用[J]. 中国生物防治, 2010, 26(2):230-234.( 1) 1) |
| [17] | 裘娟萍. 用管碟法测定碱性蛋白酶活力[J]. 氨基酸和生物资源, 1996, 18(2): 20-24.( 1) 1) |
| [18] | 樊陈, 王茂广, 高兆建. 产低温弹性蛋白酶菌株的高效诱变及酶学特性[J]. 食品科学, 2013, 34(19): 190-194.( 1) 1) |
| [19] | 李安琪, 蓝江林, 刘波, 等. 美丽短芽胞杆菌(Brevibacillus formosus)FJAT-10011抑菌效应及其产蛋白酶条件优化[J]. 福建农业学报, 2015, (10):958-964.( 1) 1) |
| [20] | GAURAV P, ANIL P, PAVANI J VP, et al.Production, optimization and partial purification of protease from Bacillus subtilis[J]. Journal of Taibah University for Science, 2015,9(1):50-55.( 1) 1) |
| [21] | YOUNG-OK KIM, IN-SUK PARK, DAE-JUNG KIM, et al. Identification and characterization of a bacteriocin produced by an isolated Bacillus sp. SW1-1 that exhibits antibacterial activity against fish pathogens[J].Journal of the Korean Society for Applied Biological Chemistry,2014,57(5):605-612.( 1) 1) |
| [22] | NALISA K,SURASAK S,PEERAPOL S,et al. Antibacterial activity and genotypic-phenotypic characteristics of bacteriocin-producing Bacillus subtilis KKU213: Potential as a probiotic strain[J]. Microbiological Research,2015,170:36-50.( 1) 1) |
| [23] | 郑广荣, 梁樱凡, 杜倩, 等. 一株产酸蜡状芽胞杆菌的筛选及其抑菌特性研究[J]. 四川大学学报:自然科学版, 2013, 50(6): 1379-1384.( 1) 1) |
| [24] | 高兆建, 巫有华, 张桂英, 等. 短芽胞杆菌低温弹性蛋白酶酶学特性分析[J]. 生物技术通报, 2012, (9):149-154.( 1) 1) |
| [25] | 王亚茹, 姚斌, 曾虹, 等. 枯草芽胞杆菌中性植酸酶的纯化和酶学性质[J]. 微生物学报, 2001, 41(2): 198-203.( 1) 1) |
| [26] | 刘新月, 李凡, 陈海如, 等. 致病性尖孢镰刀菌生物防治研究进展[J]. 云南大学学报:自然科学版, 2008, 30(S1):89-93.( 1) 1) |
| [27] | 孙志颖, 郭云霞, 张鹏辉. 鸡源芽孢益生菌的筛选及JM-11菌株的鉴定[J]. 饲料研究, 2011, (2):36-39.( 1) 1) |
| [28] | 孟小亮, 陈昌福, 高宇, 等. 1株黄颡鱼肠道益生菌的筛选与鉴定[J]. 华中农业大学学报, 2010, 29(2):208-212.( 1) 1) |
| [29] | GHOLIZADEH S S, BASERISALEHI M, BAHADOR N. Study on Bioactive Compounds Produced by Soil Origin Brevibacillus spp.[J]. Nature Environment and Pollution Technology, 2013,12(2):209-214.( 1) 1) |
| [30] | 唐兵, 周林峰, 陈向东, 等.嗜热脂肪芽抱杆菌高温蛋白酶的产生条件及酶学性质[J]. 微生物学报, 2000, 40(2):188-192.( 1) 1) |
 2015, Vol. 30
2015, Vol. 30
