2. 福建省福安市畜牧兽医局, 福建 福安 355000
2. Station of Animal Husbandy and Veterinary of Fu'an, Fu'an, Fujian 355000, China
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea Virus,PEDV)引起猪的一种高度接触性肠道传染病,发病特征主要表现为感染猪群腹泻、呕吐、脱水和消瘦死亡。PEDV与猪传染性胃肠炎病毒 (Transmissible gastroenteritis virus,TGEV) 均为冠状科病毒,它们引发的临床症状和致病机理非常相似[1]。该病于1971年英国首次报道,我国在1980年发现该病以后[2],全国各地陆续有PED发生的报道。随着PEDV疫苗的问世和应用,PED在一定程度上得到较好控制。过去的30多年,PEDV主要是感染保育猪和育肥猪,且病死率不是很高。但近年来,包括韩国、泰国、日本在内的亚洲国家纷纷报道严重PED疫情,出现7日龄以内哺乳仔猪发病后死亡率可达到100%,对养殖场造成严重损失,这说明PED在亚洲区域猪群中的流行形势十分严峻。近年欧美均有PED的报道,2013年美国PED发病情况严重。
从2010年下半年开始PED在我国再次爆发并流行,也造成大量哺乳仔猪发病死亡,致死率最高可达100%。如蔡汝健等[3] 于2010-2013年对华南地区60个规模猪场的粪便进行PEDV检测,发现猪场的阳性率高达100%,猪群平均死亡率为76.87%。杜晓莉等[4]于2010-2013年对浙江省342份疑似腹泻病料样品进行检测,病料阳性率达到69.30%。由此,PED在我国发病比较严重,并再次成为大家的共同研究探讨的热点。为了解2011年以来PED在福建省的流行情况和PEDV的主要结构蛋白-S蛋白的变异规律,较系统获得PED流行病学数据,本研究对2011-2014年采自117个规模猪场的295份疑似PED的病料进行检测,并对14株具有代表性的PEDV毒株进行S蛋白基因序列比对分析。
1 材料与方法 1.1 试验材料 1.1.1 病料来源2011-2014年采自全省各地疑似发生PED规模猪场的病料。病料均来源于发病哺乳仔猪的小肠及肠道内容物。
1.1.2 主要试剂病毒DNA/RNA提取试剂盒购自TANGEN公司,PCR扩增试剂盒购自北京全式金生物科技有限公司,Ex Taq 酶、AMV酶、Rnase Inhition 、dNTP和DNA Marker-2000、大肠杆菌感受态DH5α购自TaKaRa公司,PMD18-T Vector购自大连宝生生物工程有限公司,Nucleanse-Free Water购自Promega公司,胶回收试剂盒和质粒提取试剂盒购自OMEGA公司。
1.2 试验方法 1.2.1 PEDV检测(1)引物设计与合成 根据Genbank登录的CV777标准毒株E基因的保守序列,设计合成了1对扩增片段的引物,引物由宝生物工程(大连)有限公司合成。其引物序列如下(表 1)。
| 表 1 基因序列扩增引物情况 Tab.1 Amplification primers of gene sequence |
(2)核酸提取及RT-PCR反应 提取核酸RNA:按照TransGen病毒RNA/DNA提取试剂盒说明书进行。RT反应:25 μL的反转录反应体系中先加6 μL RNA与1 μL下游引物70℃水浴10 min,冰浴2 min,之后按顺序加入DEPC水7.0 μL,5×AMV Buffer 5.0 μL,dNTP Mixture 4.0 μL,Rnase Inhition 1.0μL,AMV 1.0 μL;反应条件为42℃ 60 min,4℃保存。PCR反应:TaKaRa Ex Taq(5 units·μL-1) 0.25 μL,10 ×Ex Taq Buffer 5.0 μL,dNTP Mixture(2.5 mmol·L-1each)4.0 μL,上游引物0.5 μL,下游引物0.5 μL,反转录产物 3.0 μL,DEPC水36.25 μL,扩增条件为95℃预变性5 min,94℃变性1 min,52℃复性1 min,72℃延伸2 min,35个循环;72℃终延伸10 min,4℃保存。反应结束后,取7 μL扩增产物进行1%琼脂糖凝胶电泳,观察结果。
1.2.2 14株PEDV的S基因的扩增(1)引物设计与合成:根据CV777标准毒株的S基因序列,设计合成2对扩增S基因片段的引物,由宝生物工程(大连)有限公司合成。其引物序列如表 2所示。
| 表 2 基因序列扩增引物情况 Tab.2 Amplification primers of gene sequence |
(2)核酸提取及RT-PCR反应:参照1.2.1(2),PCR复性温度为48~50℃。
(3)按照OMEGA公司的Gel DNA Extraction kit 200的说明书进行目的片段回收,回收产物连接到PMD18-T转化到感受态细胞,提取阳性质粒送送至生工生物工程(上海)有限公司进行序列测定。
(4)利用DNAMAN软件将所测定的S1基因和S2基因进行序列拼接。利用 DNAMAN和DNAStar软件对所得到的S基因与GenBank上已登录的参考毒株进行序列比对,分析其同源性,构建遗传进化树。
2 结果与分析 2.1 PEDV检测结果通过对2011-2014年采集的临床疑似PEDV病料采用RT-PCR方法进行检测发现,PED一年四季都可发生,但主要在较寒冷的冬春季节,规模较小的猪场由于饲养管理等技术比较薄弱及疫苗免不到位的情况下,发病较为严重,病死率可高达90%以上。数据统计分析表明2011-2014年PEDV的阳性率逐年有所下降,其中以2011年猪场阳性率和病料阳性率最高,分别为85.71%和87.3%,以2014年猪场阳性率和病料阳性率最低,分别为39.13%和34.15%;2011-2014年猪场阳性率和病料阳性率分别为64.57%和69.94%,具体情况如表 3所示。由此可见,虽然近年来PEDV在福建省发病率有所下降,仍然比较流行,防控压力依旧十分严峻。
| 表 3 2011-2014年福建省PEDV检测情况 Tab.3 Clinical detection of PED viruses,2011-2014 |
根据样品采集时间和地点对选取的14株克隆毒株分别命名为FJ-FQ1 2012 (福清)、FJ-FQ2 2012 (福清)、FJ-LY 2012(龙岩)、FJ-ND 2012(宁德)、FJ-CL 2013(长乐)、FJ-QK 2013(青口)、FJ-LY 2013(龙岩)、FJ-ND 2013(宁德)、FJ-QZ 2013(泉州)、FJ-PT 2013(莆田)、FJ-YX 2013(云霄)、FJ-ZP 2013(漳浦)、FJ-FQ 2014(福清)、FJ-ZP 2014(漳浦),最终将测定的基因序列分别提交到GenBank上,并获得登录号(表 4)。通过应用软件进行S基因序列比对分析,发现14株PEDV 的S基因中有2株(FJ-FQ2 2012、FJ-ZP 2013) 是由4158个核苷酸组成,剩下的12株(FJ-FQ1 2012等)由4161个核苷酸组成。它们分别编码1385和1386个氨基酸。通过与参考毒株(表 5)比对分析,发现14株克隆株氨基酸存在64个点突变、5个插入和2个缺失现象,变异情况与2014年王隆柏[5]报道的基本一致。表明近年来在福建省流行的PEDV毒株在S基因片段变异程度较大。
| 表 4 PEDV的S基因登录号 Tab.4 Accession number of S gene |
| 表 5 PEDV的S基因序列比较的参考毒株 Tab.5 Reference strain for S genes of PED virus |
14株PEDV分离株S基因核苷酸和推导的氨基酸序列的同源性分别为98.5%~100.0%和98.1%~100.0%。它们与中国 (BJ 2011 1、GD-B、LZC、JS-2004-2、SD-M)株之间核苷酸和推导的氨基酸序列的同源性分别为93.3%~99.5%和91.7%~99.3%,其中与中国2004年和2006年发生的其他PEDV毒株的同源性较低,与2011和2012年流行的其他PEDV同源性较高;与韩国 (KNU-0901、SM98)株的同源性分别为93.5%~95.1%和92.1%~95.0%;与日本(83P-5、NK)株的同源性分别为94.0~94.9%和93.1~94.2%;与美国(IA1、MN)株的同源性分别为98.7%~99.4%和 98.4%~99.4%;与泰国NPPED2008_2株的同源性分别为95.8%~96.1%和94.3~95.3%;与attenuated DR13弱毒株的同源性分别为93.8%~94.1%和92.4%~93.3%,与CV777标准株的同源性分别为93.8%~94.1%和92.8%~93.7%(图 1)。

|
图 1 PEDV的S基因核苷酸同源性比较 Fig. 1 Nucleotide homology on S gene of PED virus |
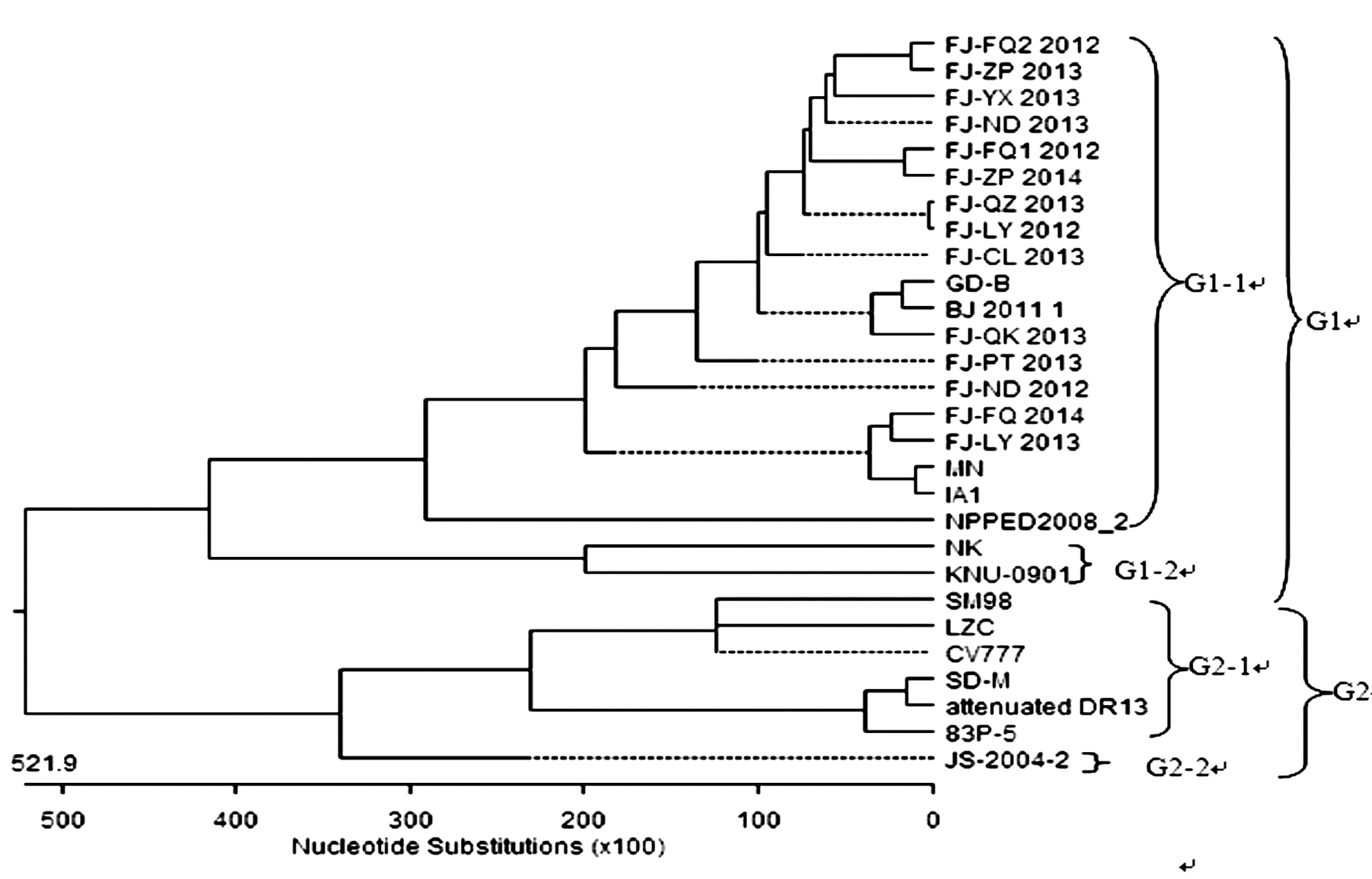
遗传进化树结果表明:PEDV可分为2个群(G1、G2),第Ⅰ群由2个亚群组成,14株PEDV福建分离株分属于第Ⅰ-1亚群中,第Ⅰ-1亚群由FJ-FQ2 2012、FJ-ZP 2012、FJ-YX 2013、FJ-ND 2013、FJ-FQ1 2012、FJ-ZP 2014、FJ-QZ 2013、FJ-LY 2012、FJ-CL 2013、FJ-QK 2013、FJ-PT 2013 、FJ-ND 2012、FJ-FQ 2014、 FJ-LY 2013、中国(BJ 2011 1、GD-B)株、美国(IA1、MN)株和泰国NPPED2008_2株组成;第Ⅰ-2亚群由日本NK株和韩国KNU-0901株组成。第Ⅱ群由2个亚群组成,第Ⅱ-1亚群由CV777标准株、韩国(attenuated DR13、SM98)株、中国(SD-M、LZC)株和日本83P-5株组成;中国江苏JS-2004 2株独立为第Ⅱ-2亚群。14株福建克隆株与2013年美国(IA1、MN)株、2011年北京BJ 2011 1株、2012年广东GD-B株、2009年韩国KNU-0901株、2008年泰国NPPED2008_2株亲缘关系较近,与attenuated DR13弱毒株及CV777标准株亲缘关系比较远(图 2)。
|
图 2 PEDV的S基因核苷酸遗传进化树 Fig. 2 Construction of phylogenetic tree for S gene nucleotide sequence of PED virus |
PED是由PEDV引起猪的一种急性、高度接触性肠道传染病,带毒猪和病猪是主要传染源,母猪的乳汁也是哺乳仔猪感染PED病毒垂直传播的途径[6]。该病能致各种年龄的猪群感染发病,但主要发生在冬季和春季的寒冷潮湿的季节。福建地处亚热带地区,冬春季低温多雨的天气持续时间较长,对仔猪的保温不利,因此为PED的流行创造有利的条件。根据2011-2014年临床检测样品分析,猪群发病主要集中在冬春季节,少部分在炎热的夏季也有发生。在被检测的117个规模猪场的295份病料中,PEDV猪场总阳性率为64.57%,病料总阳性率为69.49%。,其中PED刚开始流行不久的2011年猪场阳性率和病料阳性率最高,均在85.0%以上,以后逐年开始下降,以2014年猪场阳性率和病料阳性率为最低。究其原因,笔者认为自从2010年大规模发病以来,养殖企业一是更加重视种猪群各种疫苗免疫,尤其是对PEDV疫苗;二是更加注重猪群的营养、饲养管理及生物安全措施,尤其是对那些规模较小的猪场;三是历经了PED之后,养殖户对PED有更多的了解和防控经验等综合因素。
PEDV 属于冠状病毒科,冠状病毒属,病毒粒子呈多形性,其基因组为单股正链RNA。编码S、E、M和N结构蛋白,其中S蛋白由1383个氨基酸组成,是病毒的囊膜蛋白,根据其他冠状病毒S 蛋白序列可以将PEDV S 蛋白划分为S1 区(1~789 位氨基酸) 和S2 区(790~ 1383 位氨基酸)[7],S蛋白在受体细胞结合吸附、膜融合等方面发挥重要作用;也是诱导机体产生保护性中和抗体的主要免疫蛋白[8, 9]。由于受到宿主免疫选择的压力,S 蛋白易发生变异,同时作为RNA病毒,在不同的猪群环境、免疫压力和药物作用条件下极有可能发生变异[10],因此常被用来研究不同年代和地点发生的病毒亲缘关系。另外,研究发现与PEDV相近的猪传染性胃肠炎病毒S蛋白的变异会导致其宿主范围,组织细胞培养及毒力发生改变[11, 12]。陈建飞等[13]发现不同地区的病毒毒株已发现明显的差异。刘孝珍[14]等对8个省2个直辖市的多份病料分离的PEDV进行S基因变异分析,发现S基因变异程度较大。本课题组的研究结果也表明,近年临床检测到的PEDV S基因片段存在多个氨基酸突变、插入或缺失的现象,且以attenuated DR13弱毒株、CV777疫苗毒株和2010年以前国内流行的PEDV毒株的同源性较低,与近年来东南亚其他国家(如泰国)流行的PEDV 和2010以后国内流行的其他毒株有较高的同源性,且隶属于同一分支,有较近的亲缘关系。由此可以推断表明,2011年以来福建流行PEDV毒株的S基因片段较以往流行毒株发生了较大程度的变异,可能致传统疫苗毒株对猪群的保护率有所下降,病死率增多。
根据2011-2014年福建省PEDV检测和对毒株的S基因片段变异情况可知,PED在福建省的发病情况仍然比较严重,且流行毒株较以往和疫苗毒株出现的较大的变异,导致养猪企业防控压力依旧十分严峻,尤其对哪些规模较小,技术含量比较低的小型猪场,发病后能致初生仔猪90%以上发病死亡,造成重大的经济损失。因此,在做好猪群的饲养管理、其他疫苗免疫和生物安全的同时,应根据猪场的实际情况,在做好生物安全措施的同时,选用当前上市新型的PEDV疫苗,对更有效防控PED发生和流行,具有重要意义。
| [1] | CAVANAGH D, BRIAN D A, BRUTON P,et al. Nidovirales: a new order comprising Coronaviridae and Arteriviridae[J]. Arch Virol,1997,142(3):629-633.( 1) 1) |
| [2] | THANAWONGNUWECH R. Genetic Characterization of Porcine Epidemic Diarrhea Virus (PEDV) Isolates from Southern Vietnam during 2009-2010 Outbreaks[J]. Board of Reviewing Editors, 2011,41(1): 55-64.( 1) 1) |
| [3] | 董彦鹏,白娟,范宝超,等.猪流行性腹泻病毒RT-PCR检测与ORF3基因分子流行病学调查[J].中国预防兽医学报,2013,35(7):555-558.( 1) 1) |
| [4] | 杜晓莉,王一成,吴润,等. 2010—2013 年浙江省猪流行性腹泻病毒临床检测及PEDV-S基因型分析[J].浙江农业学报,2014,26(3):581-587.( 1) 1) |
| [5] | 王隆柏,林裕胜,车勇良,等.猪流行性腹泻病毒S、N和ORF3基因的遗传变异分析[J].畜牧兽医学报,2014,45(11): 1830-1836.( 1) 1) |
| [6] | SUN RUI-QIN, CAI RU-JIAN, CHEN YA-QIANG, et al. Outbreak of porcine epidemic diarrhea in suckling piglets, China [J]. Emerg Infect Dis, 2012, 18(1):161-163.( 1) 1) |
| [7] | SUN D B,FENG L,SHI H Y,et al. Spike protein region (aa636789) of porcine epidemic diarrhea virus is essential for induction of neutralizing antibodies[J].Acta Virologica,2007,51(3): 149-156.( 1) 1) |
| [8] | YEO S G, HERNANDEZ M, KRELL P J, et al. Cloning and sequence analysis of the spike gene of porcine epidemic diarrhea virus Chinju99 [J]. Virus Gene, 2003, 26(3): 239-246.( 1) 1) |
| [9] | KANG T,SEO J,KIM D,et al. Cloning and sequence analysis of the Korean strain of spike gene of porcine epidemic diarrhea virus and expression of its neutralizing epitope in plants[J].Protein Expression and Purification,2005,41(2): 378-383.( 1) 1) |
| [10] | 甘振磊,汤德元,李春燕,等. 猪流行性腹泻流行特点及流行现状的研究[J]. 猪业科学,2010,(12): 30-34.( 1) 1) |
| [11] | KWON H M, SAIF L J, JACKWOOD D J. Field isolates of transmissible gastroenteritis virus differ at the molecular level from the Miller and Purdue virulent and attenuated strains and from porcine respiratory coronaviruses [J]. Journal of Veterinary Medical Science,1998,60(5): 589-597.( 1) 1) |
| [12] | BALLESTEROS M L,SANCHEZ C M,ENJUANES L,et al. Two amino acid changes at the N-terminus of transmissible gastroenteritis coronavirus spike protein result in the loss of enteric tropism [J]. Virology,1997,227(2): 378-88.( 1) 1) |
| [13] | 陈建飞,冯力,时洪艳,等. 猪流行性腹泻病毒CH/S 株N蛋白基因的遗传变异及其原核表达[J].中国预防兽医学报,2007,(11): 224-229.( 1) 1) |
| [14] | 刘孝珍,陈建飞,时洪艳,等. 2011 年猪流行性腹泻病毒的遗传变异分析[J].中国预防兽医学报,2012, 34(3):180-183.( 1) 1) |
 2015, Vol. 30
2015, Vol. 30
